Содержание:
Внутренняя энергия:
Вы знаете, что движущееся тело обладает кинетической энергией. А если оно еще и взаимодействует с другим телом, то обладает потенциальной энергией. Оба вида энергии представляют собой механическую энергию. Они взаимно превращаемы: кинетическая энергия может переходить в потенциальную и наоборот. Кроме того, вы знаете, что любое тело имеет дискретную структуру, т. е. состоит из частиц (атомов, молекул). Частицы находятся в непрерывном хаотическом движении. А частицы жидкости и твердого тела еще и взаимодействуют между собой. Следовательно, частицы обладают кинетической, а частицы жидкости и твердых тел — еще и потенциальной энергией. Сумма кинетической и потенциальной энергий всех частиц тела называется внутренней энергией. Внутренняя энергия измеряется в джоулях. Чем отличается внутренняя энергия от механической? В чем ее особенности? Может ли механическая энергия переходить во внутреннюю?
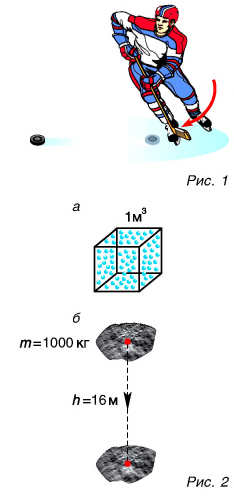
Для ответа на эти вопросы рассмотрим пример. Шайба, двигавшаяся горизонтально по льду (рис. 1), остановилась. Как изменилась ее механическая энергия относительно льда?
Кинетическая энергия шайбы уменьшилась до нуля. Положение шайбы над уровнем льда не изменилось, шайба не деформировалась. Значит, изменение потенциальной энергии равно нулю. Означает ли это, что се механическая (кинетическая) энергия исчезла бесследно? Нет. Механическая энергия шайбы перешла во внутреннюю энергию шайбы и льда.
А может ли внутренняя энергия тела, как механическая, быть равной нулю? Движение частиц, из которых состоит тело, не прекращается даже при самых низких температурах. Значит, тело всегда (подчеркиваем, всегда) обладает некоторым запасом внутренней энергии. Его можно либо увеличить, либо уменьшить — и только!
Велико ли значение внутренней энергии тела? Энергия одной частицы, например кинетическая, в силу незначительности ее массы чрезвычайно мала. Расчеты для средней энергии поступательного движения молекулы кислорода показывают, что ее значение при комнатной температуре
Главные выводы:
- Независимо от того, есть у тела механическая энергия или нет, оно обладает внутренней энергией.
- Внутренняя энергия тела равна сумме кинетической и потенциальной энергий частиц, из которых оно состоит.
- Внутренняя энергия тела всегда не равна нулю.
Способы изменения внутренней энергии
Чтобы изменить механическую энергию тела, надо изменить скорость его движения, взаимодействие с другими телами или взаимодействие частей тела. Вы уже знаете, что это достигается совершением работы.
Как можно изменить (увеличить или уменьшить) внутреннюю энергию тела? Рассуждаем логически. Внутренняя энергия определяется как сумма кинетической и потенциальной энергий частиц. Значит, нужно изменить либо скорость движения частиц, либо их взаимодействие (изменить расстояния между ними). Очевидно, можно изменить и скорость, и расстояния между частицами одновременно. Изменить скорость частиц тела можно, увеличив или уменьшив его температуру. Действительно, наблюдения за диффузией показывают, что быстрота ее протекания увеличивается при нагревании (рис. 4, а, б).
Значит, увеличивается средняя скорость движения частиц, а следовательно, их средняя кинетическая энергия. Отсюда следует важный вывод: температура является мерой средней кинетической энергии частиц.
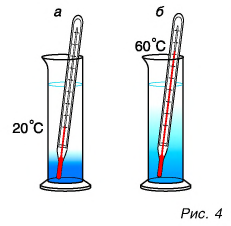
Как изменить кинетическую энергию частиц тела? Существуют два способа. Рассмотрим их на опытах. Будем натирать колбу с воздухом полоской сукна (рис. 5).
Через некоторое время уровень жидкости в правом колене манометра (см. рис. 5) опустится, т. е. давление воздуха в колбе увеличится. Это говорит о нагревании воздуха. Значит, увеличилась скорость движения и кинетическая энергия его молекул, а следовательно, и внутренняя энергия. Но за счет чего? Очевидно, за счет совершения механической работы при трении сукна о колбу. Нагрелась колба, а от нее — газ.
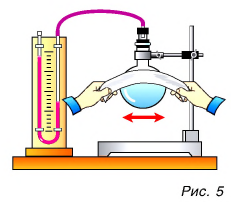
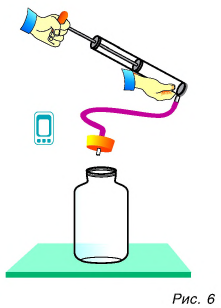
Проведем еще один опыт. В толстостенный стеклянный сосуд нальем немного воды (чайную ложку для увлажнения воздуха в нем. Насосом (рис. 6) будем накачивать в сосуд воздух. Через несколько качков пробка вылетит, а в сосуде образуется туман. Из наблюдений за окружающей средой мы знаем, что туман появляется тогда, когда после теплого дня наступает холодная ночь. Образование тумана в сосуде свидетельствует об охлаждении воздуха, т. е. об уменьшении его внутренней энергии. Но почему уменьшилась энергия? Потому что за ее счет совершена работа по выталкиванию пробки из сосуда.
Сравним результаты опытов. В обоих случаях изменилась внутренняя энергия газа, но в первом опыте она увеличилась, так как работа совершалась внешней силой (над колбой с газом), а во втором — уменьшилась, ибо работу совершала сила давления самого газа.
А можно ли, совершая работу, изменить потенциальную энергию взаимодействия молекул?
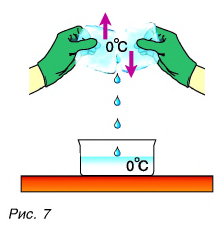
Опять обратимся к опыту. Два куска льда при О °C будем тереть друг о друга (рис. 7).
Лед превращается в воду, при этом температура воды и льда остается постоянной, равной О °C (см. рис. 7). На что тратится механическая работа силы трения?
Конечно же, на изменение внутренней энергии!
Но кинетическая энергия молекул не изменилась, так как температура не изменилась. Лед превратился в воду. При этом изменились силы взаимодействия молекул 
Совершение механической работы — один из способов изменения внутренней энергии тела.
А есть ли возможность изменить внутреннюю энергию тела, не совершая механическую работу?
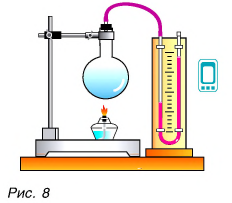
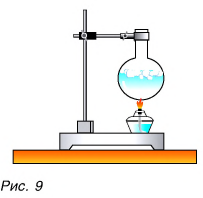
Да, есть. Нагреть воздух в колбе (рис. 8), расплавить лед (рис. 9) можно с помощью спиртовки, передав и воздуху, и льду теплоту. В обоих случаях внутренняя энергия увеличивается.
При охлаждении тел (если колбы со льдом и воздухом поместить в морозильник) их внутренняя энергия уменьшается. Теплота от тел передается окружающей среде.
Процесс изменения внутренней энергии тела, происходящий без совершения работы, называется теплопередачей (теплообменом).
Таким образом, совершение механической работы и теплопередача — два способа изменения внутренней энергии тела.
Величину, равную изменению внутренней энергии при теплопередаче, называют количеством теплоты (обозначается Q). Единицей количества теплоты, как работы и энергии, в СИ является 1 джоуль.
Для любознательных:
Физики XVIII в. и первой половины XIX в. рассматривали теплоту не как изменение энергии, а как особое вещество — теплород — жидкость (флюид), которая может перетекать от одного тела к другому. Если тело нагревалось, то считалось, что в него вливался теплород, а если охлаждалось — то выливался. При нагревании тела расширяются. Это объяснялось тем, что теплород имеет объем. Но если теплород — вещество, то тела при нагревании должны увеличивать свою массу. Однако взвешивания показывали, что масса тела не менялась. Поэтому теплород считали невесомым. Теорию теплорода поддерживали многие ученые, в том числе и такой гениальный ученый, как Г. Галилей. Позже Дж. Джоуль на основании проведенных им опытов пришел к выводу, что теплород не существует и что теплота есть мера изменения кинетической и потенциальной энергий движущихся частиц тела.
В дальнейшем выражение «сообщить телу количество теплоты» мы будем понимать как «изменить внутреннюю энергию тела без совершения механической работы, т. е. путем теплообмена». А выражение «нагреть тело» будем понимать как «повысить его температуру» любым из двух способов.
Главные выводы:
- Внутреннюю энергию тела можно изменить путем совершения механической работы или теплопередачи (теплообмена).
- Изменение внутренней энергии при нагревании или охлаждении тела при постоянном объеме связано с изменением средней кинетической энергии его частиц.
- Изменение внутренней энергии тела при неизменной температуре связано с изменением потенциальной энергии его частиц.
Основы термодинамики
МКТ стала общепризнанной на рубеже XIX и XX веков. Задолго до ее создания исследованием тепловых процессов занималась термодинамика — раздел физики, изучающий превращение внутренней (тепловой) энергии в другие виды энергии и наоборот, а также количественные соотношения при таких превращениях.
- Заказать решение задач по физике
Внутренняя энергия и ее особенности
Внутренняя энергия макроскопического тела определяется характером движения и взаимодействия всех микрочастиц, из которых состоит тело (система тел). Таким образом, к внутренней энергии следует отнести:
- кинетическую энергию хаотического (теплового) движения частиц вещества (атомов, молекул, ионов);
- потенциальную энергию взаимодействия частиц вещества;
- энергию взаимодействия атомов в молекулах (химическую энергию);
- энергию взаимодействия электронов и ядра в атоме и энергию взаимодействия нуклонов в ядре (внутриатомную и внутриядерную энергии).
Однако для описания тепловых процессов важно не столько значение внутренней энергии, как ее изменение. При тепловых процессах химическая, внутриатомная и внутриядерная энергии практически не изменяются. Именно поэтому внутренняя энергия в термодинамике определяется как сумма кинетических энергий хаотического (теплового) движения частиц вещества (атомов, молекул, ионов), из которых состоит тело, и потенциальных энергий их взаимодействия.
Внутреннюю энергию обозначают символом U.
Единица внутренней энергии в СИ — джоуль: [U]=1 Дж (J).
Особенности внутренней энергии идеального газа
- Атомы и молекулы идеального газа практически не взаимодействуют друг с другом, поэтому внутренняя энергия идеального газа равна кинетической энергии поступательного и вращательного движений его частиц.
- Внутренняя энергия данной массы идеального газа прямо пропорциональна его абсолютной температуре. Докажем данное утверждение для одноатомного газа. Атомы такого газа движутся только поступательно, поэтому, чтобы определить его внутреннюю энергию, следует среднюю кинетическую энергию поступательного движения атомов умножить на количество атомов:
Итак, для одноатомного идеального газа:
. Используя уравнение состояния
, выражение для внутренней энергии идеального одноатомного газа можно представить так:
- Внутренняя энергия — функция состояния системы, то есть она однозначно определяется основными макроскопическими параметрами (p, V, T), характеризующими систему. Независимо от того, каким образом система переведена из одного состояния в другое, изменение внутренней энергии будет одинаковым.
- Внутреннюю энергию можно изменить двумя способами: совершением работы и теплопередачей.
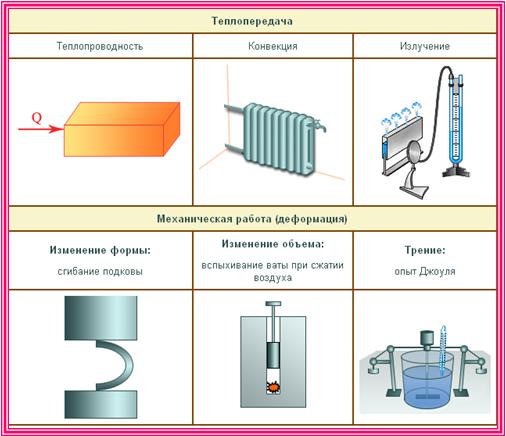
Какие существуют виды теплопередачи
Теплопередача (теплообмен) — процесс изменения внутренней энергии тела или частей тела без совершения работы. Процесс теплопередачи возможен только при наличии разности температур. Самопроизвольно тепло всегда передается от более нагретого тела к менее нагретому. Чем больше разность температур, тем быстрее — при прочих равных условиях — протекает процесс передачи тепла.
| Виды теплопередачи | ||
|---|---|---|
| Теплопроводность | Конвекция | Излучение |
|
Вид теплопередачи, который обусловлен хаотическим движением частиц вещества и не сопровождается переносом этого вещества. Лучшие проводники тепла — металлы, плохо проводят тепло дерево, стекло, кожа, жидкости (за исключением жидких металлов); самые плохие проводники тепла — газы. Передача энергии от горячей воды к батарее отопления, от поверхности воды до ее нижних слоев и т. д. происходит благодаря теплопроводности. |
Вид теплопередачи, при котором тепло переносится потоками жидкости или газа. Теплые потоки жидкости или газа имеют меньшую плотность, поэтому под действием архимедовой силы поднимаются, а холодные потоки — опускаются. Благодаря конвекции происходит циркуляция воздуха в помещении, нагревается жидкость в стоящей на плите кастрюле, существуют ветры и морские течения и т. д. В твердых телах конвекция невозможна. | Вид теплопередачи, при котором энергия передается посредством электромагнитных волн. Излучение — универсальный вид теплопередачи: тела всегда излучают и поглощают инфракрасное (тепловое) излучение. Это единственный вид теплообмена, возможный в вакууме (энергия от Солнца передается только излучением). Лучше излучают и поглощают энергию тела с темной поверхностью. |
Как определить количество теплоты
Количество теплоты Q — это физическая величина, равная энергии, которую тело получает (или отдает) в ходе теплопередачи.
Единица количества теплоты в СИ — джоуль: [П] =1 Дж (J).
Из курса физики 8 класса вы знаете, что количество теплоты, которое поглощается при нагревании вещества (или выделяется при его охлаждении), вычисляют по формуле: Q=cm∆Т=cm∆t , где c — удельная теплоемкость вещества; m — масса вещества; 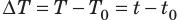
Обратите внимание! Произведение удельной теплоемкости на массу вещества, из которого изготовлено тело, называют теплоемкостью тела: C=cm . Если известна теплоемкость C тела, то количество теплоты, которое получает тело при изменении температуры на ∆T, вычисляют по формуле: Q=C∆T .
| Расчет количества теплоты при фазовых переходах | |
|---|---|
| Кристаллическое состояние ↔ Жидкое состояние | Жидкое состояние ↔ Газообразное состояние |
|
Температуру, при которой происходят фазовые переходы «кристалл → жидкость» и «жидкость → кристалл», называют температурой плавления. Температура плавления зависит от рода вещества и внешнего давления. Количество теплоты Q, которое поглощается при плавлении кристаллического вещества (или выделяется при кристаллизации жидкости), вычисляют по формуле: Q = λm, где m — масса вещества; λ — удельная теплота плавления. |
Фазовые переходы «жидкость → пар» и «пар → жидкость» происходят при любой температуре. Количество теплоты Q, которая поглощается при парообразовании (или выделяется при конденсации), вычисляют по формуле: Q=rm (Q=Lm), где m — масса вещества; r (L) — удельная теплота парообразования при данной температуре (обычно в таблицах представлена удельная теплота парообразования при температуре кипения жидкости). |
| Напомним: и при плавлении, и при кипении температура вещества не изменяется. |
Пример решения задачи №1
Неон массой 100 г находится в колбе объемом 5,0 л. В процессе изохорного охлаждения давление неона уменьшилось с 100 до 50 кПа. На сколько при этом изменились внутренняя энергия и температура неона?
Решение:
Неон — одноатомный газ; для таких газов изменение внутренней энергии равно:
Поскольку охлаждение изохорное, объем неона не изменяется: 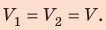
Проверим единицы, найдем значения искомых величин:
Анализ результатов. Знак «–» свидетельствует о том, что внутренняя энергия и температура неона уменьшились, — это соответствует изохорному охлаждению. Ответ: ∆U = –375 Дж; ∆T = –6 К.
Пример решения задачи №2
Внутренний алюминиевый сосуд калориметра имеет массу 50 г и содержит 200 г воды при температуре 30 °С. В сосуд бросили кубики льда при температуре 0 °С, в результате чего температура воды в калориметре снизилась до 20 °С. Определите массу льда. Удельные теплоемкости воды и алюминия: 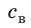
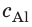
Анализ физической проблемы.
Калориметр имеет такое устройство, что теплообмен с окружающей средой практически отсутствует, поэтому для решения задачи воспользуемся уравнением теплового баланса. В теплообмене участвуют три тела: вода, внутренний сосуд калориметра, лед.
Решение:
Запишем уравнение теплового баланса:
После преобразований получим:
Проверим единицу, найдем значение искомой величины:
Ответ: 
Выводы:
- В термодинамике под внутренней энергией U тела понимают сумму кинетических энергий хаотического движения частиц вещества, из которых состоит тело, и потенциальных энергий их взаимодействия. Внутренняя энергия однозначно определяется основными макроскопическими параметрами (p, V, T), характеризующими термодинамическую систему. Внутреннюю энергию идеального одноатомного газа определяют по формулам:
- Внутреннюю энергию можно изменить двумя способами: совершением работы и теплопередачей. Существует три вида теплопередачи: теплопроводность, конвекция, излучение.
- Физическую величину, равную энергии, которую тело получает или отдает при теплопередаче, называют количеством теплоты (Q): Q=cm∆T = С∆T — количество теплоты, которое поглощается при нагревании тела (или выделяется при его охлаждении); Q = λm — количество теплоты, которое поглощается при плавлении вещества (или выделяется при кристаллизации); Q=rm (Q=Lm) — количество теплоты, которое поглощается при парообразовании вещества (или выделяется при конденсации).
- Теплопроводность в физике
- Конвекция в физике
- Излучение тепла в физике
- Виды излучений в физике
- Машины и механизмы в физике
- Коэффициент полезного действия (КПД) механизмов
- Тепловые явления в физике
- Тепловое движение в физике и его измерение
Наука о тепловых явлениях называется термодинамика. Термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем.
При изучении основ термодинамики необходимо помнить следующие определения. Физическая система, состоящая из большого числа частиц — атомов или молекул, которые совершают тепловое движение и, взаимодействуя между собой, обмениваются энергиями, называется термодинамической системой.
Состояние термодинамической системы определяется макроскопическими параметрами, например удельным объемом, давлением, температурой.
Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. Важным свойством термодинамически равновесной системы является выравнивание температуры всех ее частей.
Термодинамика рассматривает только равновесные состояния, т.е. состояния, в которых параметры термодинамической системы не меняются со временем.
Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом.
Термодинамическим процессом называется переход системы из начального состояния в конечное через последовательность промежуточных состояний.
Процессы бывают обратимыми и необратимыми.
Обратимым называется такой процесс, при котором возможен обратный переход системы из конечного состояния в начальное через те же промежуточные состояния, чтобы в окружающих телах не произошло никаких изменений. Обратимый процесс является физической абстракцией. Примером процесса, приближающегося к обратимому, является колебание тяжелого маятника на длинном подвесе. В этом случае кинетическая энергия практически полностью превращается в потенциальную, и наоборот. Колебания происходят долго без заметного уменьшения амплитуды ввиду малости сопротивления среды и сил трения.
Любой процесс, сопровождаемый трением или теплопередачей от нагретого тела к холодному, является необратимым. Примером необратимого процесса является расширение газа, даже идеального, в пустоту. Расширяясь, газ не преодолевает сопротивления среды, не совершает работы, но, для того чтобы вновь собрать все молекулы газа в прежний объем, т. е. привести газ в начальное состояние, необходимо затратить работу. Таким образом, все реальные процессы являются необратимыми.
Изменение внутренней энергии газа в процессе теплообмена и совершаемой работы.
Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом.
Внутренняя энергия – это сумма энергий молекулярных взаимодействий и энергии теплового движения молекул.
В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема (закон Джоуля).
Молекулярно-кинетическая теория приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др.), молекулы которого совершают только поступательное движение:
Поскольку потенциальная энергия взаимодействия молекул зависит от расстояния между ними, в общем случае внутренняя энергия
U тела зависит наряду с температурой T также и от объема V: U = U(T, V).
Таким образом, внутренняя энергия системы зависит только от её состояния и является однозначной функцией состояния, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние.
Внутреннюю энергию тела можно изменить разными способами:
- Совершение механической работы.
- Теплообмен.
Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную).
Например, газ подвергается сжатию в цилиндре под поршнем площадью S. Поршень, сжимая газ, движется с некоторой скоростью v. Молекулы газа, беспорядочно двигаясь, ударяются о поршень. После упругого удара молекулы о поршень скорость молекулы возрастает, а значит возрастает и её кинетическая энергия, что приводит к увеличению внутренней энергии газа.
При сжатии газа его внутренняя энергия увеличивается за счет совершения поршнем механической работы. При расширении газа его внутренняя энергия уменьшается, превращаясь в механическую энергию поршня.
При сжатии газа внешние силы совершают над газом некоторую положительную работу A’.
В то же время силы давления, действующие со стороны газа на поршень, совершают работу
A = –A’.
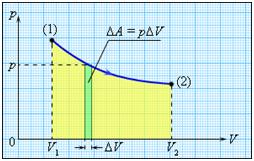
Если объем газа изменился на малую величину ΔV, то газ совершает работу pSΔx = pΔV, где p – давление газа, S – площадь поршня, Δx – его перемещение.
При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна.
В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой:
или в пределе при ΔVi → 0: 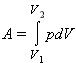
Работа численно равна площади под графиком процесса на диаграмме (p, V):
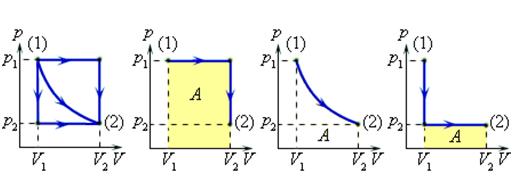
Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное. На рис. 2 изображены три различных процесса, переводящих газ из состояния (1) в состояние (2). Во всех трех случаях газ совершает различную работу.
Рисунок 2.
Три различных пути перехода из состояния (1) в состояние (2).
Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса.
Процессы, изображенные на рис. 2, можно провести и в обратном направлении; тогда работа A просто изменит знак на противоположный.
Процессы которые можно проводить в обоих направлениях, называются обратимыми.
В отличие от газа, жидкости и твердые тела мало изменяют свой объем, так что во многих случаях работой, совершаемой при расширении или сжатии, можно пренебречь. Однако, внутренняя энергия жидких и твердых тел также может изменяться в результате совершения работы. При механической обработке деталей (например, при сверлении) они нагреваются. Это означает, что изменяется их внутренняя энергия.
Внутренняя энергия тела может изменяться не только в результате совершаемой работы, но и вследствие теплообмена.
При тепловом контакте тел внутренняя энергия одного из них может увеличиваться, а внутренняя энергия другого – уменьшаться. В этом случае говорят о тепловом потоке от одного тела к другому. Передача энергии от одного тела другому в форме тепла может происходить только при наличии разности температур между ними.
Приведем в соприкосновение два тела с разными температурами. Пусть температура первого тела выше, чем второго. В результате обмена энергиями температура первого тела уменьшается, а второго — увеличивается. В рассматриваемом примере кинетическая энергия хаотического движения молекул первого тела переходит в кинетическую энергию хаотического движения молекул второго тела.
Тепловой поток всегда направлен от горячего тела к холодному.
Процесс передачи внутренней энергии без совершения механической работы называется теплообменом.
Мерой энергии, получаемой или отдаваемой телом в процессе теплообмена, служит физическая величина, называемая количеством теплоты.
Количеством теплоты Q, полученной телом, называют изменение внутренней энергии тела в результате теплообмена.
Количество теплоты Q является энергетической величиной. В СИ количество теплоты измеряется в единицах механической работы – джоулях (Дж).
До введения СИ количество теплоты выражали в калориях.
Калория — это количество теплоты, необходимое для нагревания 1 г дистиллированной воды на 1°С, от 19,5°С до 20,5°С.
Единица, в 1000 раз большая калории, называется килокалорией (1 ккал = 1000 кал). Соотношение между единицами: 1 кал =4,19 Дж.
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются.
Чтобы нагреть тело массой m от температуры t1 до температуры t2 ему необходимо сообщить количество теплоты
Q = cm(t2 – t1)
Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c.
c = Q / (mΔT).
Во многих случаях удобно использовать молярную теплоемкость C:
C = M · c, где M – молярная масса вещества.
При передаче тепла от одного тела к другому всегда выполняется уравнение теплового баланса, по которому количество теплоты Q1, отданное первым телом, равно количеству теплоты Q2, полученному вторым телом.
Q1 = Q2
Теплота и работа являются не видом энергии, а формой ее передачи, они существуют лишь в процессе передачи энергии.
В реальных условиях оба способа передачи энергии системе в форме работы и форме теплоты обычно сопутствуют друг другу.
Первое начало термодинамики.
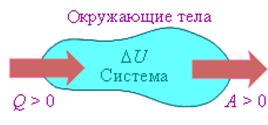
На рисунке изображены энергетические потоки между термодинамической системой и окружающими телами. в результате теплообмена и совершаемой работы:
Величина Q > 0, если тепловой поток нправлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную работу над окружающими телами.
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, то есть изменяются ее макроскопические параметры (температура, давление, объем).
Процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
ΔU = Q – A.
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Q = ΔU + A.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Если между телами, составляющими замкнутую систему, действуют силы трения, то часть механической энергии превращается во внутреннюю энергию тел (нагревание).
При любых физических взаимодействиях энергия не возникает и не исчезает. Она лишь превращается из одной формы в другую. Этот экспериментально установленный факт выражает фундаментальный закон природы – закон сохранения и превращения энергии.
Задачи для самостоятельного решения ( Дмитриева В.Ф. Задачи по физике)
№ 2, стр. 148
Определите p — давление насыщенного водяного пара при температуре Т=290 К, если пло ность насыщенного водяного пара при этой температуре ρ=2,56·10-2 кг/м3 (ответ р=3,43 Па)
№ 12, стр. 149
Определите m — массу стоградусного водяного пара, необходимого для нагревания m1=10 кг воды от t1=100С до t2=600С. (ответ m=0,086 кг)
№ 1, стр. 156
Поверхностное натяжение керосина α=2,4·10-2 Н/м. Какую работу А совершат силы поверхностного натяжения при уменьшении поверхностного слоя керосина на 25 см2? (ответ А=60 мкДж)
№ 7, стр. 156
В одной и той же капиллярной трубке вода поднимается на 50 мм, а спирт на 19 мм. Определите поверхностное натяжение спирта αс. Поверхностное натяжение воды αв=0,072 Н/м (ответ αс=22·10-3 Н/м)
№ 8, стр. 163
Определите Q — теплоту, необходимую для плавления свинца массой m=10 кг, находящегос при температуре плавления. Удельная теплота плавления свинца λ=25 кДж/кг. (ответ Q=250 кДж)
Прежде чем приступить к изучению нового материала, давайте с
вами вспомним, чем мы занимались при изучении молекулярно-кинетической теории.
Там наша основная задача заключалась в установлении связи между
макроскопическими параметрами, характеризующими состояние системы, и её микроскопическими
параметрами. Это позволило нам объяснить, почему газ оказывает давление на
стенки сосуда, что такое температура и так далее.
Также мы с вами вывели уравнение состояния идеального газа. Удалось
нам это сделать только потому, что мы рассматривали самую простую систему —
идеальный газ. Напомним, что в идеальном газе отсутствуют взаимодействия между
молекулами, и поэтому нам не нужно было учитывать потенциальную энергию их взаимодействия.
Однако, если бы мы попытались построить молекулярно-кинетическую теорию
реального газа (не говоря уже о жидкостях и твёрдых телах), то всё было бы
гораздо сложнее, а порой и почти невозможно.
Но существует ещё один раздел молекулярной физики, который
пытается установить соответствия между макроскопическими параметрами, абсолютно
не интересуясь, как устроена система (то есть без учёта молекулярного строения
тел). Этот раздел физики называется термодинамикой.
Интересно, что первой научной теорией тепловых процессов была
не молекулярная физика, а именно термодинамика. Считается, что она берёт своё
начало с работы Сади Карно «О движущей силе огня и о машинах, способных
развивать эту силу», опубликованной в 1824 году.
А становление термодинамики как науки началось примерно в
40-х годах XIX века после того, как Юлиус Майер, Герман
Гельмгольц и Джеймс Джоуль количественно определили связь между механической
работой и теплотой и сформулировали универсальный закон сохранения и
превращения энергии.
Выводы термодинамики основаны на фундаментальных законах,
называемых началами термодинамики. Это не теоретические законы. Все они
были установлены в результате обобщения многочисленных экспериментальных
фактов.
Все физические тела и их модели в термодинамике мы будем
называть термодинамическими системами. При этом для каждой
изолированной термодинамической системы существует состояние термодинамического
равновесия, в которое она переходит самопроизвольно. Это утверждение называют нулевым
началом термодинамики.
Основным понятием в термодинамике является понятие внутренней
энергии, о которой мы говорили ещё в восьмом классе. Давайте с вами
вспомним, что под внутренней энергией тела (или системы тел) понимают сумму
кинетической энергии хаотического теплового движения молекул и потенциальной
энергии их взаимодействия.
Обозначают внутреннюю энергию большой латинской буквой U. А измеряют её в тех же единицах, что и механическую
энергию, то есть в джоулях.
[U] = [Дж].
Теперь давайте с вами вспомним, от каких величин зависит
внутренняя энергия тела или системы тел. Мы уже с вами знаем, что чем выше
температура тела, тем быстрее движутся его молекулы и тем больше их
кинетическая энергия. Значит, внутренняя энергия тела зависит от его
температуры.
Также нам известно, что для перевода вещества, например, из
жидкого состояния в газообразное, нужно к веществу подвести энергию.
Следовательно, пар будет обладать большей внутренней энергией, чем жидкость той
же массы. Значит, внутренняя энергия тела при неизменной массе зависит от
его агрегатного состояния.
Ну а так как масса тела равна сумме масс составляющих его
частиц, то внутренняя энергия зависит и от массы тела.
Но внутренняя энергия тела не зависит от его механического
движения и от его взаимодействия с другими телами. Так, например, внутренняя
энергия мяча, лежащего на полу и поднятого на некоторую высоту от пола,
одинакова, так же как и мяча, неподвижного и катящегося по полу (если, конечно,
пренебречь силами сопротивления его движению).
Рассчитать внутреннюю энергию можно только для идеального
газа. Давайте с вами определим внутреннюю энергию идеального одноатомного газа,
то есть газа, состоящего из отдельных атомов (к такому газу относятся инертные
газы — гелий, неон, аргон и так далее).
Итак, согласно модели идеального газа, его молекулы не
взаимодействуют друг с другом. Поэтому внутренней энергией такого газа является
сумма кинетических энергий хаотического движения всех его молекул или атомов.
Следовательно, внутренняя энергия идеального одноатомного газа равна
произведению средней кинетической энергии теплового движения молекул на их
число:
Число молекул в данной порции газа мы можем легко выразить из
определения количества вещества:
А значение средней кинетической энергии поступательного
движения молекул мы распишем через постоянную Больцмана и абсолютную
температуру:
Перепишем формулу для внутренней энергии с учётом последних
двух формул:
Теперь давайте с вами вспомним, что произведение постоянной
Больцмана и числа Авогадро — это есть универсальная газовая постоянная R. Тогда получаем, что внутренняя энергия идеального
одноатомного газа прямо пропорциональна его абсолютной температуре и не зависит
от других макроскопических параметров системы:
Для примера давайте с вами определим внутреннюю энергию неона
массой 5 г, находящегося при температуре 27 оС.
Как правило, значение внутренней энергии в большинстве
случаев вычислить очень трудно, поскольку каждое тело состоит из огромного
числа частиц. Однако нас чаще будет интересовать не само значение внутренней
энергии, а её изменение, которое происходит при переходе системы из одного
состояния в другое.
Под приращением (или изменением) внутренней энергии
понимают разность внутренних энергий системы в конечном и начальном состояниях:
∆U = U2
– U1.
Например, переход некоторой массы идеального газа из
состояния один в состояние три можно осуществить или в ходе изохорного
нагревания и последующим изобарным расширением, или при изобарном расширении, а
затем при изохорном нагревании. Однако изменение внутренней энергии газа и в одном
и в другом случае будет одинаковым:
∆U123
= ∆U143 = U3 – U1.
Иными словами, внутренняя энергия является функцией состояния
системы. Это означает, что изменение внутренней энергии при переходе
термодинамической системы из одного состояния в другое зависит только лишь от
значений параметров этих состояний, а не от процесса перехода.
В частности, изменение внутренней энергии данной масса идеального
одноатомного газа происходит только при изменении его температуры:
В качестве примера решим такую задачу. На рисунке в
координатах (p, V) изображён процесс перехода идеального одноатомного
газа определённой массы из состояния 1 в состояние 2. Определите приращение
внутренней энергии газа, если его давление в конечном состоянии составляет 2
МПа, а объём в начальном состоянии был равен 3,0 л.
В заключении урока отметим, что при определении внутренней
энергии реальных газов, жидкостей и твёрдых тел необходимо ещё учитывать и потенциальную
энергию взаимодействия частиц, которая зависит от расстояния между ними.
Поэтому в общем случае внутренняя энергия макроскопических тел зависит не
только от абсолютной температуры, но и от объёма.
При изучении физики в восьмом классе вы узнали, что изменить
состояние термодинамической системы можно двумя способами: используя
теплопередачу или совершая работу. Процесс теплопередачи и совершение работы
характеризуют соответственно физическими величинами — количеством теплоты Q и работой А, которые являются мерами изменения
внутренней энергии системы.
Скачать материал

Скачать материал


- Сейчас обучается 51 человек из 20 регионов






Описание презентации по отдельным слайдам:
-
1 слайд
Внутренняя энергия макроскопической системы.
Тепловое равновесие -
2 слайд
Цели урока: повторить первое начало термодинамики и рассмотреть понятие внутренней энергии и способы ее изменения.
-
3 слайд
Внутренняя энергия макроскопческой системы
Внутренней энергией макроскопической системы называют сумму кинетической энергии движения составляющих его частиц (молекул, атомов, ионов) и потенциальной энергии их взаимодействия. Обозначают внутреннюю энергию буквой U. Единицей внутренней энергии является джоуль (Дж).
Внутренняя энергия, так же как температура, давление и объём (термодинамические параметры), характеризует состояние системы. При изменении состояния системы изменяется и значение её внутренней энергии. -
4 слайд
От чего зависит внутренняя энергия тела
Так как температура тела прямо пропорциональна средней кинетической энергии составляющих его частиц, то внутренняя энергия тела зависит от его температуры и об изменении внутренней энергии можно судить по изменению температуры тела.
Внутренняя энергия тела зависит и от его агрегатного состояния. Так, она больше у стоградусного пара, чем у воды такой же массы при той же температуре, что объясняется различием потенциальных энергий взаимодействия молекул пара и воды.
Внутренняя энергия зависит и от деформации тела: она больше у деформированного тела, чем у недеформированного.
Следует иметь в виду, что внутренняя энергия тела не зависит от его движения как целого и от его положения в пространстве. Так, значения внутренней энергии у шарика, лежащего на полу, и у того же шарика, поднятого на некоторую высоту, одинаковы при одинаковых прочих условиях. -
5 слайд
СПОСОБЫ ИЗМЕНЕНИЯ ВНУТРЕННЕЙ ЭНЕРГИИ
Из курса физики основной школы вы знаете, что внутреннюю энергию макроскопической системы можно изменить в процессе совершения работы или путём теплопередачи.
Внутреннюю энергию можно изменить, не совершая работу. Например, внутренняя энергия воздуха в комнате и всех предметов, находящихся в ней, будет увеличиваться, если при закрытых окнах и дверях включить батареи центрального отопления или затопить печь. Если опустить в горячую воду ложку, то температура ложки повысится, а воды понизится. В этом случае изменение внутренней энергии макроскопических тел происходит без совершения работы в процессе теплопередачи (теплообмена).
Теплопередачей называют способ изменения внутренней энергии тела, при котором происходит передача энергии от одной части тела к другой или от одного тела к другому без совершения работы.
При теплопередаче не происходит превращения энергии из одной формы в другую, как при совершении работы. Этот процесс характеризуется передачей внутренней энергии от более нагретого тела к менее нагретому. -
6 слайд
Как вам известно, существует три вида теплопередачи: теплопроводность, конвекция и излучение.
Теплопроводность — это процесс переноса внутренней энергии от более нагретых частей тела (или тел) к менее нагретым, осуществляемый хаотически движущимися частицами (атомами, молекулами, электронами и т. п.). Явление теплопроводности заключается в том, что кинетическая энергия атомов и молекул, которая определяет температуру тела, передается либо другому телу при их взаимодействии, либо из более нагретых областей тела к менее нагретым областям.
Конвекция — это явление переноса теплоты в жидкостях или газах (реже — в сыпучих твердых веществах) потоками вещества. Естественная конвекция возникает самопроизвольно при неравномерном нагревании вещества. Например, если на кухонной плите долго готовится пища, температура воздуха под потолком становится значительно выше, чем вблизи пола. На гретый воздух — легкий, поэтому он поднимается вверх, а верхние слои более холодные, тяжелые, поэтому они опускаются вниз, после чего процесс повторяется снова и снова. Конвекцией обусловлены многие атмосферные явления, в том числе образование облаков. При принудительной конвекции перемещение вещества происходит под действием каких-то внешних сил (насоса, лопастей вентилятора и т.п.). Она применяется, когда естественная конвекция недостаточно эффективна. Система охлаждения двигателя автомобиля — пример теплопередачи за счет принудительной конвекции.
Тепловое излучение, или лучеиспускание, — это передача энергии от од них тел к другим в виде электромагнитных волн за счет их тепловой энергии. Тепловое излучение в основном приходится на инфракрасный участок спектра. Примером теплового излучения является свет от лампы накаливания. -
7 слайд
КОЛИЧЕСТВО ТЕПЛОТЫ. УДЕЛЬНАЯ ТЕПЛОЁМКОСТЬ ВЕЩЕСТВА
Мерой изменения внутренней энергии в процессе теплопередачи является количество теплоты. Количество теплоты обозначается буквой Q, единица количества теплоты — джоуль.
Количество теплоты Q, полученное или отданное телом массой m в процессе теплопередачи, рассчитывается по формуле: Q = cm(t2 – t1),
где c — удельная теплоёмкость вещества, t1 — начальная температура тела, t2 — конечная температура тела.
Как следует из приведённой формулы, если тело в процессе теплопередачи получает энергию, то t2 > t1 и Q2 > 0; если тело отдаёт энергию, то t2 < t1 и Q < 0. -
8 слайд
ТЕПЛОВОЕ РАВНОВЕСИЕ
Ежедневно вы имеете дело с телами, находящимися в различных состояниях, которые характеризуются определёнными параметрами. Например, макроскопические системы — кусок льда, принесённый в комнату зимой, и воздух в комнате — имеют разную температуру. Через некоторое время в результате теплообмена температура льда повысится, а воздуха несколько понизится, лёд растает, образовавшаяся вода нагреется и её температура станет равной температуре воздуха в комнате. Говорят, что между водой и воздухом в комнате установилось тепловое или термодинамическое равновесие, а эти макроскопические системы в данном случае представляют собой термодинамическую систему.
Термодинамическая система — это совокупность макроскопических систем, которые могут обмениваться энергией между собой и с внешними телами. -
9 слайд
Термодинамические системы бывают трех типов: изолированные, закрытые и открытые.
Изолированная термодинамическая система не может обмениваться с окружающей средой ни энергией, ни веществом. Примером такой системы может служить термос с закрытой крышкой.
Для закрытой термодинамической системы обмен энергией с окружающей средой возможен, а вот вещества ни покидать систему, ни быть добавленными к ней не могут. Примером такой системы может служить закрытая бутылка с минеральной водой. Мы можем охладить содержимое в холодильнике, но при закрытой крышке ни выпустить газ, ни добавить в бутылку что-либо не получится.
Наконец, открытая система может обмениваться с окружающей средой и веществом, и энергией. Любой живой организм — это открытая термодинамическая система.
Теплоизолированная термодинамическая система с течением времени всегда приходит в равновесное состояние и самопроизвольно выйти из него не может. Это утверждение составляет сущность закона термодинамического равновесия. -
10 слайд
Состояние системы может быть равновесным и неравновесным
Равновесное состояние характеризуется неизменностью во времени всех термодинамических параметров состояния теплоизолированной системы.
Например, если стакан c горячей водой оставить в комнате, то через некоторое время стакан и вода в нём придут в состояние термодинамического равновесия с воздухом и предметами, находящимися в комнате. При этом температура, давление и объём будут оставаться неизменными сколь угодно долго при отсутствии внешних воздействий.
Если система находится в неравновесном состоянии, то, предоставленная самой себе, с течением времени она придёт в равновесное состояние.
Напомним, что количество тепло ты, которое нужно сообщить 1 кг вещества, чтобы повысить его температуру на 1 °С, равно удельной теплоёмкости вещества. Такое же количество теплоты отдаст 1 кг вещества при понижении его температуры на 1 °С. -
11 слайд
ТЕМПЕРАТУРА
Температура — параметр, характеризующий состояние термодинамического равновесия, её значение во всех частях равновесной системы одинаково.
Сложность измерения температуры заключается в том, что её нельзя сравнить с эталоном, как, например, массу или длину. Поэтому используют зависимость от температуры физических свойств тел: объёма, давления, электрического сопротивления и т. п. Первой для измерения температуры была использована зависимость объёма жидкости от температуры. Эта зависимость легла в основу построения шкалы Цельсия, в которой за 0° принимают точку замерзания воды, а за 100° точку кипения воды при атмосферном давлении. Термометром со шкалой Цельсия измеряют температуру человека.
Другой температурной шкалой является шкала Кельвина, в которой температура отсчитывается от абсолютного нуля.
Абсолютный нуль — это такая температура, при которой прекращается тепловое движение частиц, составляющих тело. Состояния с температурой, равной абсолютному нулю, достичь нельзя, поскольку тепловое движение молекул невозможно прекратить. Сравнить шкалы Цельсия и термодинамическую можно.
Абсолютному нулю соответствуют –273,15 °С, температуре таяния льда 273,15 К, температуре кипения воды 373,15 К, а 1 °С = 1 К. -
12 слайд
Выполните задания
-
-
-
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 116 266 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Материал подходит для УМК
-
«Естествознание (базовый уровень)», Габриелян О.С., Остроумов И.Г., Пурышева Н.С. и др.
Тема
§ 26. Внутренняя энергия макроскопической системы. Тепловое равновесие
Больше материалов по этой теме
Другие материалы
- 13.11.2021
- 272
- 1

- 13.11.2021
- 111
- 1
- 12.11.2021
- 296
- 0
- 12.11.2021
- 1033
- 19
- 12.11.2021
- 121
- 0
- 11.11.2021
- 123
- 0
- 11.11.2021
- 157
- 0
Вам будут интересны эти курсы:
-
Курс повышения квалификации «Организация и руководство учебно-исследовательскими проектами учащихся по предмету «Биология» в рамках реализации ФГОС»
-
Курс повышения квалификации «ФГОС общего образования: формирование универсальных учебных действий на уроке биологии»
-
Курс повышения квалификации «Медико-биологические основы безопасности жизнедеятельности»
-
Курс повышения квалификации «Основы туризма и гостеприимства»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс профессиональной переподготовки «Естествознание: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Источники финансов»
-
Курс повышения квалификации «Составление и использование педагогических тестов при обучении биологии»
-
Курс профессиональной переподготовки «Организация деятельности помощника-референта руководителя со знанием иностранных языков»
-
Курс профессиональной переподготовки «Организация процесса страхования (перестрахования)»
-
Курс профессиональной переподготовки «Выполнение микробиологических работ»
Идеальные газы
Согласно закону Джоуля, выведенному эмпирически, внутренняя энергия идеального газа не зависит от давления или объёма. Исходя из этого факта, можно получить выражение для изменения внутренней энергии идеального газа. По определению молярной теплоёмкости при постоянном объёме, . Так как внутренняя энергия идеального газа является функцией только от температуры, то
.
Эта же формула верна и для вычисления изменения внутренней энергии любого тела, но только в процессах при постоянном объёме (изохорных процессах); в общем случае является функцией и температуры, и объёма.
Если пренебречь изменением молярной теплоёмкости при изменении температуры, получим:
,
где — количество вещества, — изменение температуры.
Внутренняя энергия
Внутренняя энергия – это кинетическая энергия всех молекул, из которых состоит тело, и потенциальная энергия их взаимодействия.
$U = E_к + E_п$,
где $U$ – внутренняя энергия, $E_к$ – кинетическая энергия молекул тела, $E_п$ – потенциальная энергия молекул тела.
В нашем опыте (рисунок 4) механическое движение прекратилось, когда шар упал на плиту. Но усилилось тепловое движение его молекул. Так механическая энергия превращается во внутреннюю энергию шара.
Теперь мы знаем два вида энергии: механическая энергия и внутренняя энергия. При рассмотрении тепловых явлений мы будем учитывать только внутреннюю энергию (энергию молекул).
Факторы влияния
Например, в результате резкого снижения температуры, связанного с обменом энергии с окружающей средой при расширении, течение возникает вследствие конденсации водяного пара. Значение ВЭ этого тела или системы трудно установить из-за его сложной природы. Это легче определить, когда более существенные изобарные изменения этой энергии обусловлены различными явлениями, такими как расширение газа под функцией давления.
Как известно, температура связана со средней КЭ молекул тела. Однако как два предмета отличаются при одинаковой температуре, но разной массе и, следовательно, разном количестве молекул, не совсем понятно. Очевидно, что сумма энергии частицы будет больше в случае тела с большей массой. Энергию энтропии, связанную с физическим движением и взаимным расположением частиц, называют ВЭ.
Из этого следует, что смысл ВЭ зависит от трёх факторов:
- количество атомов и молекул, составляющих это тело — чем больше молекул, тем выше сумма компонентов;
- температура тела — чем выше Т, тем больше средняя КЭ частиц, общая Э системы.
Характер вещества и его состояние энтальпия — понятие величины потенциальной энергии, полученной в результате межмолекулярного воздействия, зависит от состояния концентрации и различно для разных веществ.
Вот примеры:
- При той же заданной температуре воды ведро имеет больше ВЭ, чем стакан воды, так как в ведре содержится гораздо больше молекул.
- Чашка горячего чая имеет большую ВЭ, чем такое же количество холодного чая, потому что молекулы горячей жидкости имеют большую среднюю КЭ, и в обоих стаканах их столько же.
- Стакан воды при 0 ° С обладает большей ВЭ, чем кусок льда, созданный из него при той же температуре.
От чего зависит внутренняя энергия тела
Внутренняя энергия тела зависит от:
— температуры тела,
— агрегатного состояния (газообразное, жидкое, твердое),
— некоторых других факторов.
Чем выше температура тела, тем больше его внутренняя энергия.
Математики запишут это так: Внутренняя энергия – это функция температуры. Или сокращенно:
[large boxed{ U = f(T)}]
Символом T обозначена температура тела.
При равных температурах газы обладают наибольшей внутренней энергией. Внутренняя энергия жидкостей меньше, чем у газов. А внутренняя энергия твердых тел ниже, чем энергия жидкостей. Это можно изобразить с помощью рисунка 2:
Рис.2. При переходе из одного агрегатного состояния в другое, внутренняя энергия тела изменяется
Функция состояния
Важнейшее свойство внутренней энергии заключается в том, что она является функцией состояния термодинамической системы. А именно, внутренняя энергия однозначно определяется набором макроскопических параметров, характеризующих систему, и не зависит от «предыстории» системы, т.е. от того, в каком состоянии система находилась прежде и каким конкретно образом она оказалась в данном состоянии.
Так, при переходе системы из одного состояния в другое изменение её внутренней энергии определяется лишь начальным и конечным состояниями системы и не зависит от пути перехода из начального состояния в конечное. Если система возвращается в исходное состояние, то изменение её внутренней энергии равно нулю.
Опыт показывает, что существует лишь два способа изменения внутренней энергии тела:
• совершение механической работы; • теплопередача.
Попросту говоря, нагреть чайник можно только двумя принципиально разными способами: тереть его чем-нибудь или поставить на огонь 🙂 Рассмотрим эти способы подробнее.
Конвекция
Конвекция — это перенос внутренней энергии в жидкостях или газах в результате циркуляции потоков и перемешивания вещества.
Воздух вблизи батареи нагревается и расширяется. Действующая на этот воздух сила тяжести остаётся прежней, а выталкивающая сила со стороны окружающего воздуха увеличивается, так что нагретый воздух начинает всплывать к потолку. На его место приходит холодный воздух (тот же процесс, но в куда более грандиозных масштабах, постоянно происходит в природе: именно так возникает ветер), с которым повторяется то же самое.
В результате устанавливается циркуляция воздуха, которая и служит примером конвекции — распространение тепла в комнате осуществляется воздушными потоками.
Совершенно аналогичный процесс можно наблюдать и в жидкости. Когда вы ставите на плиту чайник или кастрюлю с водой, нагревание воды происходит в первую очередь благодаря конвекции (вклад теплопроводности воды тут весьма незначителен).
Конвекционные потоки в воздухе и жидкости показаны на рис. 2 (изображения с сайта physics.arizona.edu).
Рис. 2. Конвекция
В твёрдых телах конвекция отсутствует: силы взаимодействия частиц велики, частицы колеблются вблизи фиксированных пространственных точек (узлов кристаллической решётки), и никакие потоки вещества в таких условиях образоваться не могут.
Для циркуляции конвекционных потоков при отоплении комнаты необходимо, чтобы нагретому воздуху было куда всплывать. Если радиатор установить под потолком, то никакая циркуляция не возникнет — тёплый воздух так под потолком и останется. Именно поэтому нагревательные приборы помещают внизу комнаты. По той же причине чайник ставят на огонь, в результате чего нагретые слои воды, поднимаясь, уступают место более холодным.
Наоборот, кондиционер нужно располагать как можно выше: тогда охлаждённый воздух начнёт опускаться, и на его место будет приходить более тёплый. Циркуляция пойдёт в обратном направлении по сравнению с движением потоков при обогреве комнаты.
Теги
Вы уже знаете, что механическая энергия тела (кинетическая и потенциальная) может изменяться. Внутренняя энергия тела также не является постоянной величиной, она может менять свое значение.
Внутренняя энергия зависит от температуры: при ее повышении внутренняя энергия увеличивается. Происходит это за счет увеличения средней скорости движения молекул и возрастания их кинетической энергии.
При понижении температуры внутренняя энергия, наоборот, понижается. Значит, внутренняя энергия тела меняется при изменении скорости движения молекул.
На данном уроке мы выясним, каким способом можно изменить скорость движения молекул. Таким образом, мы определим, при каких условиях происходит изменение внутренней энергии и дадим определения новым понятиям.
Совершение работы над телом
Рассмотрим опыт, представленный на рисунке 1.
У нас есть металлическая трубка, закрепленная на подставке. Наливаем в трубку немного эфира.
Эфир — бесцветная летучая жидкость. Часто употребляется в технике и медицине для дезинфекции. Имеет температуру кипения около $35 degree C$.
Закрываем пробкой. Обвиваем вокруг трубки веревку, и начинаем быстро двигать ее в разные стороны. Что произойдет?
После некоторого времени наших манипуляций с веревкой, эфир закипит. Его пар вытолкнет пробку.
Такой способ используется при разведении огня в диких условиях. Древние люди обладали им в совершенстве. При вращении сухой кусок дерева нагревался более чем на $250 degree C$ и загорался.
Внутренняя энергия эфира изменилась — она увеличилась. Он не только нагрелся, но и закипел. Натирая трубку веревкой, мы совершали механическую работу.
Также тела нагреваются при деформациях. То есть при ударах (вспомните опыт из прошлого урока с шаром из свинца), разгибании, сгибании (можно провести простой опыт, сгибая медную проволоку) и др.
Внутреннюю энергию тела можно увеличить, совершая над телом работу.
Когда нам холодно, мы начинаем дрожать — происходят мышечные сокращения. Таким образом наш организм увеличивает температуру тела — за счет работы мышц увеличивается внутренняя энергия.
Совершение работы самим телом
Рассмотрим опыт, представленный на рисунке 2.
У нас имеется стеклянный сосуд, который закрывается пробкой. В пробке есть специальное отверстие. Через него с помощью насоса начнем закачивать в сосуд воздух.
Через некоторое время пробка вылетит. В этот момент можно заметить как образуется туман. Это означает, что воздух в сосуде стал холоднее.
Вытолкнув пробку, сжатый воздух в сосуде совершил работу. При этом температура воздуха понизилась. Так мы можем сказать, что его внутренняя энергия тоже уменьшилась.
Если работу совершает само тело, то его его внутренняя энергия уменьшается.
Внутреннюю энергию тела можно изменить путем совершения работы.
Теплопередача
Можно ли изменить внутреннюю энергию тела без совершения работы?
Мы часто наблюдаем ситуации, когда увеличивается температура тела. Например, закипание воды в чайнике, воздух нагревается от батарей отопления в квартире, нагреваются предметы, оставленные на солнце. Работа во всех этих примерах не совершается.
Попробуем объяснить увеличение внутренней энергии в таких случаях на следующем примере. Опустим обычную металлическую ложку в стакан с горячей водой (рисунок 3).
Что будет происходить?
- Температура горячей воды намного больше температуры холодной ложки. Значит, кинетическая энергия молекул воды больше кинетической энергии частиц металлической ложки
- Молекулы воды начинают взаимодействовать с частицами металла — передают им часть своей кинетической энергии
- Энергия молекул воды уменьшается, энергия частиц металла увеличивается
- Температура воды уменьшается, температура ложки увеличивается
- Вскоре им температуры выравниваются
Внутреннюю энергию тела можно изменить путем теплопередачи.
Теплопередача — это процесс изменения внутренней энергии без совершения работы самими телом или над ним.
- Происходит между телами с разной температурой
- Идет в направлении от тел с более высокой температурой к телам с более низкой
- Заканчивается, когда температуры тел выравниваются (становятся равны друг другу)
В мороз многие водоплавающие птицы (например, утки) охотно залезают в воду. В такую погоду температура воды выше температуры воздуха, что позволяет птицам не замерзать.
Способы изменения внутренней энергии тела
Итак,
внутреннюю энергию можно изменить двумя способами: совершая механическую работу или теплопередачей.
Существует три вида теплопередачи:
- Теплопроводность
- Конвекция
- Излучение
Виды теплопередачи будут изучены нами в следующих уроках.

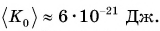
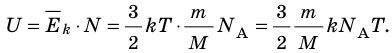 Итак, для одноатомного идеального газа:
Итак, для одноатомного идеального газа: 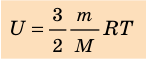 . Используя уравнение состояния
. Используя уравнение состояния 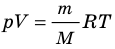 , выражение для внутренней энергии идеального одноатомного газа можно представить так:
, выражение для внутренней энергии идеального одноатомного газа можно представить так: 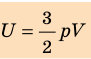

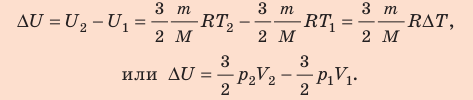
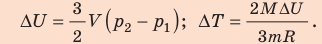
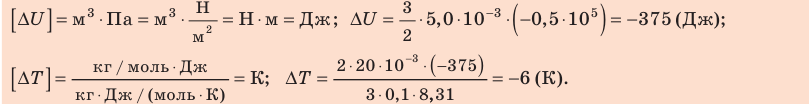
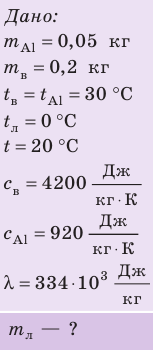
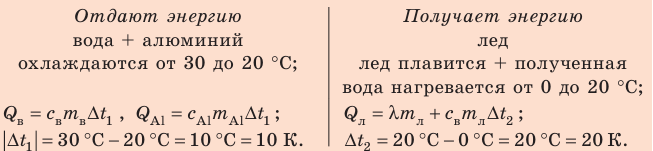
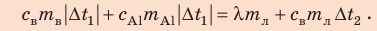
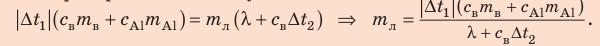
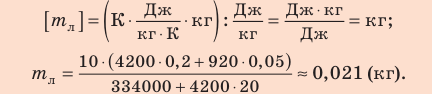
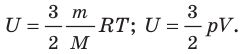















 .
. ,
,
