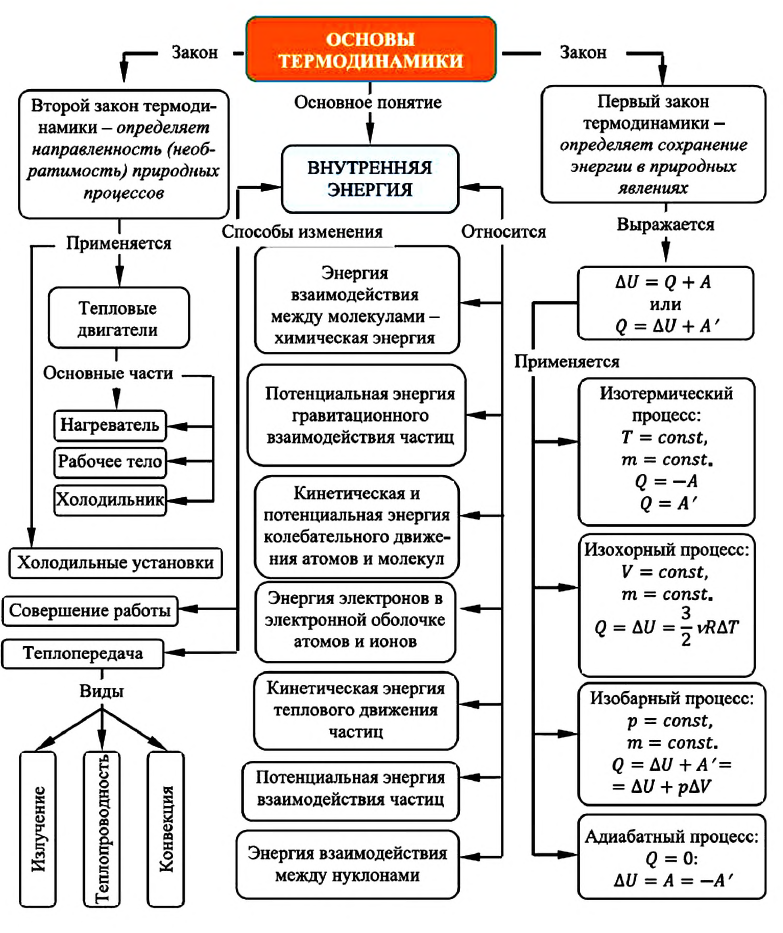
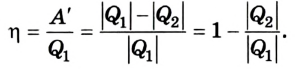
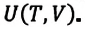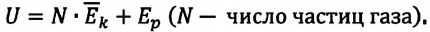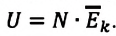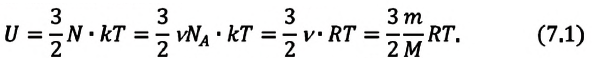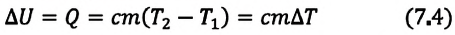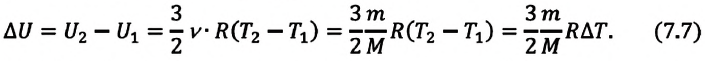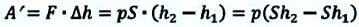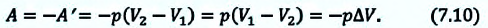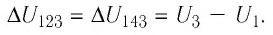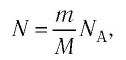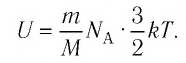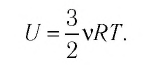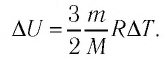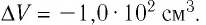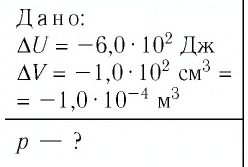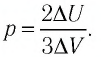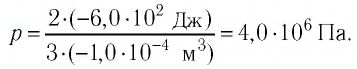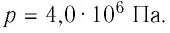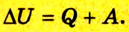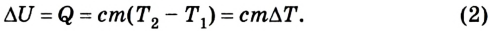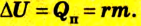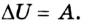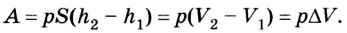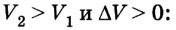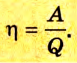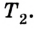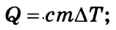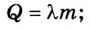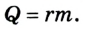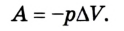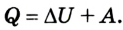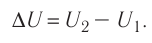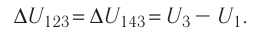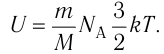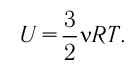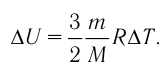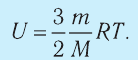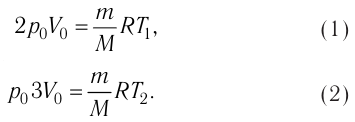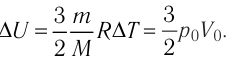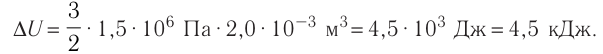1. Внутренняя энергия газа
Из курса физики основной школы вы знаете, что сумму кинетической энергии хаотического движения частиц и потенциальной энергии их взаимодействия называют внутренней энергией.
Внутренняя энергия U данной массы одноатомного идеального газа равна произведению средней кинетической энергии 
U = 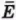
? 1. Объясните, почему внутренняя энергия U данной массы одноатомного идеального газа выражается формулой
Итак, внутренняя энергия идеального газа определяется только его абсолютной температурой и числом молекул в нем.
? 2. Объем одного моля газа при температуре 20 ºС и нормальном атмосферном давлении составляет 24 л.
а) Чему равна внутренняя энергия этого газа, если он одноатомный и его можно считать идеальным?
б) На какую высоту можно было бы забросить мяч массой 365 г, если бы можно было сообщить ему такую кинетическую энергию и пренебречь сопротивлением воздуха?
Выполнив это задание, вы сможете представить, как велика внутренняя энергия тела. Объясняется это тем, что скорость хаотического движения молекул в десятки и сотни раз превышает скорости движения окружающих нас тел. А кинетическая энергия пропорциональна квадрату скорости. Поэтому при увеличении скорости в 10 раз кинетическая энергия увеличивается в 100 раз, а при увеличении скорости в 100 раз кинетическая энергия увеличивается в 10 000 раз.
Внутреннюю энергию идеального одноатомного газа можно выразить также через его давление p и объем V.
? 3. Объясните, почему внутренняя энергия U данной массы одноатомного идеального газа выражается формулой
U = (3/2)pV. (2)
Подсказка. Воспользуйтесь формулой (1) и уравнением состояния идеального газа.
? 4. Из формулы (1) следует, что внутренняя энергия одного моля газа зависит только от его абсолютной температуры и количества вещества (числа молекул). А из формулы (2) следует, что она зависит от давления и объема, но зато не зависит от количества вещества. Объясните, почему тут нет противоречия.
? 5. Ширина класса 5 м, длина 10 м, а высота – 4 м. Температура воздуха 20 ºС, давление равно нормальному атмосферному давлению.
а) Чему была бы равна внутренняя энергия газа, заполняющего класс, если бы он был одноатомным? (Воздух состоит в основном из двухатомных молекул. Как показывает расчет, выходящий за рамки нашего курса, внутренняя энергия двухатомного газа при тех же макроскопических параметрах в 5/3 раза больше, чем внутренняя энергия одноатомного газа.)
б) На какую высоту можно было бы поднять автомобиль массой 1 т, затратив такую энергию?
в) Есть ли в условии лишние данные?
Результаты выполнения этого задания раскроют, какая огромная энергия «окружает» каждого из нас! А ведь мы ее практически не замечаем, считая воздух «пустотой».
Большую внутреннюю энергию имеют, конечно, и другие тела. Например, внутренняя энергия литра кипятка больше внутренней энергии того же литра воды при комнатной температуре на величину, равную работе, которую надо совершить для того, чтобы поднять легковой автомобиль на двенадцать этажей!
При изучении тепловых явлений мы учитываем только кинетическую энергию хаотического движения молекул и потенциальную энергию их взаимодействия. А ведь есть еще и во много раз большая энергия взаимодействия частиц в атомных ядрах. Вы знаете о ней из курса физики основной школы. К ядерной физике мы вернемся в 11-м классе.
Соотношение между различными видами энергии, которыми обладает данное тело, схематически представлено на рисунке 42.1. Мы видим, что непосредственно наблюдаемая механическая энергия составляет лишь очень малую долю всей энергии тела. Соблюсти масштаб на этом рисунке невозможно, потому что тепловая внутренняя энергия в тысячи раз больше механической, а ядерная – в миллионы раз больше тепловой.
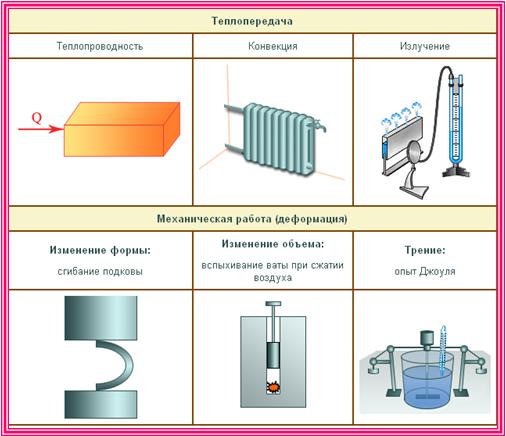
Два способа изменения внутренней энергии
Из курса физики основной школы вы знаете, что внутреннюю энергию тела можно изменить двумя способами:
- совершая работу над телом – например, сжимая газ (рис. 42.2, а);
- посредством теплопередачи, то есть без совершения работы, – например, при контакте с более горячим телом (рис. 42.2, б). (Теплопередачу называют иногда также теплообменом.)
Напомним, что меру изменения внутренней энергии при теплопередаче называют количеством теплоты и обозначают Q. Количество теплоты измеряют в джоулях.
Как мы знаем, внутренняя энергия данной массы идеального газа определяется только его температурой и числом молекул. Поэтому при постоянном числе молекул изменить внутреннюю энергию идеального газа можно только изменив его температуру.
Например, при сжатии газа в теплоизолированном сосуде газ нагревается вследствие того, что над ним производят работу. Нагревание газа может быть при атом весьма заметным.
Поставим опыт
Поместим кусочек сухой ваты в толстостенный прозрачный цилиндр и быстро (резким толчком) вдвинем в цилиндр поршень (рис. 42.3).
Воздух в цилиндре нагреется так сильно, что вата воспламенится.
Нагревание газа при сжатии используют в дизельных двигателях: при сжатии горючая смесь в цилиндре нагревается настолько, что воспламеняется без искры.
Газовый процесс, который происходит в теплоизолированном сосуде, то есть без теплопередачи, называют адиабатным. Адиабатным можно считать также процесс, когда тепло- передачей можно пренебречь: например, если процесс происходит за время, в течение которого не успевает произойти теплообмен с окружающей средой.
При адиабатном расширении газ охлаждается. По этой причине, например, образуются облака. Поднимающийся влажный воздух попадает в более разреженные слои атмосферы, расширяется и вследствие этого охлаждается. Как мы увидим далее, при охлаждении ниже определенной температуры (точки росы) содержащийся в воздухе водяной пар конденсируется: образуются капельки тумана, из которого и состоят облака.
Увеличить или уменьшить температуру газа можно, конечно, и посредством теплопередачи. Например, сосуд с газом можно поместить над огнем, в кипящую воду или в морозильную камеру.
? 6. Изменяется ли, н если да, то как внутренняя энергия данной массы идеального газа:
а) при изотермическом расширении? сжатии?
б) при изобарном расширении? сжатии?
в) при изохорном охлаждении? нагревании?
г) при адиабатном сжатии? расширении?
2. Первый закон термодинамики
Итак, внутренняя энергия газа U может изменяться как вследствие того, что ему сообщают количество теплоты Q, так и потому, что внешние силы совершают работу A над газом.
Согласно закону сохранения энергии
изменение внутренней энергии газа ∆U равно сумме количества теплоты Q, переданного газу, и работы A, совершенной над газом:
∆U = Q + A. (3)
Закон сохранения энергии применительно к тепловым явлениям называют первым законом термодинамики. (Термодинамикой называют раздел физики, изучающий общие законы тепловых явлений.)
Как Q, так и A могут быть положительными, отрицательными или равными нулю. Если газ сжимают, то A > 0, а если он расширяется, то A < 0. Если объем газа не изменяется, то A = 0. Если газу передают некоторое количество теплоты, то Q > 0, а если газ отдает некоторое количество теплоты, то Q < 0.
В практических расчетах и при решении многих задач часто используют другую формулировку первого закона термодинамики. Дело в том, что при рассмотрении тепловых двигателей главный интерес представляет работа, совершенная самим газом (то есть силой давления, действующей со стороны газа на поршень; при расширении газа работа газа положительна).
Обозначим работу газа Aг. Она связана с работой A, совершенной внешними силами над газом, соотношением
Aг = –A.
При сжатии газа A > 0, Aг < 0; а при расширении газа A < 0, Aг > 0.
Используя понятие работы газа, первый закон термодинамики формулируют так:
количество теплоты, переданное газу, равно сумме изменения внутренней энергии газа и работы, совершенной газом:
Q = ∆U + Aг. (4)
Чтобы использовать соотношения (3) и (4) на практике, надо уметь находить выражения для изменения внутренней энергии газа и работы газа (или работы внешних сил).
Как найти изменение внутренней энергии газа?
Для одноатомного идеального газа внутренняя энергия выражается формулой (1), поэтому для изменения ∆U внутренней энергии получаем:
∆U = (3/2)νR∆T. (5)
Здесь ∆T = T2 – T1, ∆U = U2 – U1, а индексами 1 и 2 обозначены соответственно начальное и конечное состояния газа.
? 7. Начальная температура пяти молей гелия 100 ºС. Газ нагрели на 50 ºС.
а) Насколько увеличилась внутренняя энергия газа?
б) Есть ли в условии лишние данные?
Изменение внутренней энергии одноатомного идеального газа можно найти и с помощью формулы (2):
∆U = (3/2)∆(pV). (6)
Здесь ∆(pV) – изменение произведения давления на объем. Например, при переходе газа из состояния 1 в состояние 2
∆(pV) = p2V2 – p1V1. (7)
? 8. Чему равно изменение внутренней энергии одного моля одноатомного идеального газа:
а) при изобарном расширении, если давление газа равно p0, а объем газа увеличился от V0 до 3V0?
б) при изохорном охлаждении, если объем газа равен V0, а давление газа уменьшилось от p0 до 0,5p0?
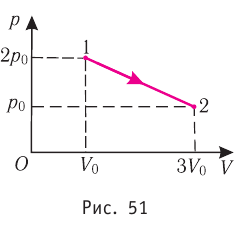
в) в процессе, в котором начальные давление и объем газа равны p0 и V0, а конечные равны 2p0 и 3V0?
Есть ли в условии лишние данные?
Важным достоинством формулы (6) является то, что в нее не входят ни количество вещества в газе, ни его масса. Поэтому, например, если давление и объем газа остались неизменными, то не изменилась и внутренняя энергия газа, хотя при этом могла измениться его масса. Рассмотрим пример, в котором речь идет о воздухе, который состоит в основном из двух- атомных молекул. Их средняя кинетическая энергия при заданной температуре больше, чем у одноатомных молекул (двухатомные молекулы обладают еще кинетической энергией вращательного движения). Однако для выполнения следующего задания то, что воздух состоит из двухатомных молекул, несущественно.
? 9. До включения отопления температура воздуха в комнате объемом 60 м3 была равна 15 ºС. После включения отопления воздух нагрелся до 20 ºС. Давление воздуха постоянно и равно 105 Па.
а) На сколько процентов увеличилась средняя кинетическая энергия молекул в воздухе?
б) Как изменилась внутренняя энергия воздуха в комнате?
в) На сколько процентов изменилась концентрация молекул воздуха?
г) Насколько изменилась масса воздуха в комнате?
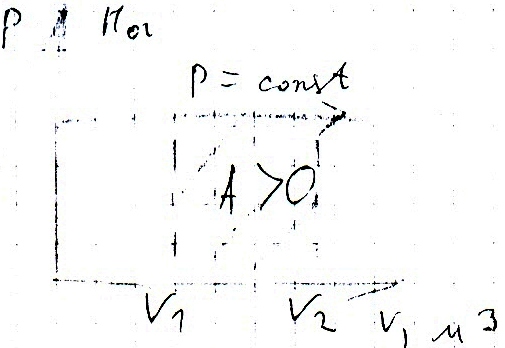
Как найти совершенную газом работу?
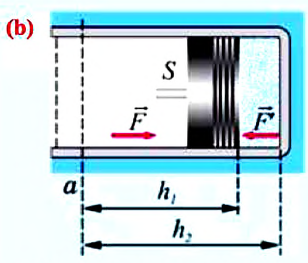
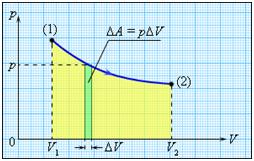
Рассмотрим сначала изобарное расширение газа в цилиндре под поршнем (рис. 42.4). Газ давит на поршень с силой F = pS, где p – давление газа, S – площадь поршня.
Если поршень переместился на ∆x, то совершенная газом работа Aг = F * ∆x = pS * ∆x. Так как S * ∆x = ∆V, получаем, что при изобарном расшинерии работа газа выражается формулой
Aг = p * ∆V. (8)
? 10. Используя рисунок 42.5, объясните, почему работа газа численно равна площади фигуры под графиком зависимости p(V).
Это свойство графика зависимости p(V) сохраняется и тогда, когда давление газа изменяется.
Пусть, например, график зависимости p(V) имеет вид, изображенный на рисунке 42.6. Процесс расширения газа мысленно разобьем на большое число этапов, в каждом из которых объем газа изменяется настолько мало, что его давление можно считать практически постоянным. Поскольку для каждого этапа работа газа численно равна площади под соответствующим участком графика, то и вся работа, совершенная газом при расширении, равна площади под всем графиком p(V).
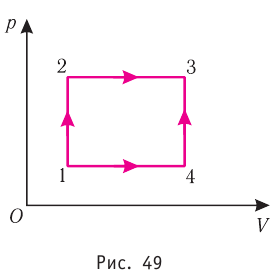
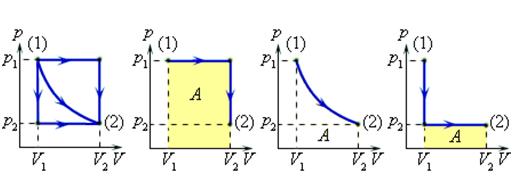
? 11. Один моль идеального газа можно перевести из состояния 1 в состояние 2 многими способами. Рассмотрим процессы, которым соответствуют графики а и б (рис. 42.7).
а) В каком случае совершенная газом работа больше? Во сколько раз больше?
б) В каком случае изменение внутренней энергии газа больше? Во сколько раз больше?
в) В каком случае переданное газу количество теплоты больше? Во сколько раз больше?
На примере этого задания вы могли заметить, что изменение ∆U внутренней энергии данной массы идеального газа определяется только начальным и конечным состоянием газа.
Обусловлено это тем, что каждому состоянию данной массы газа (с определенными значениями p, V и T) соответствует одно определенное значение внутренней энергии, которое можно найти либо по формуле (1), либо по формуле (2).
А вот работа, совершенная газом при переходе из начального состояния в конечное, зависит от характера процесса, которым газ был переведен из начального состояния в конечное.
Действительно, работа газа численно равна площади под графиком зависимости p(V). А эта площадь зависит от того, какой вид имела функция p(V).
Если газ не расширяется, а сжимается (рис. 42.8), то внешние силы производят работу над газом. В таком случае говорят также, что газ производит отрицательную работу. Она численно равна взятой со знаком минус площади S под графиком зависимости p(V).
На том, что работа газа зависит от вида зависимости p(V), а не только от начального и конечного состояния, основан принцип действия тепловых двигателей (в следующем параграфе мы рассмотрим их подробнее).
В тепловых двигателях газ расширяется при высокой температуре. При атом давление газа велико, поэтому он совершает большую работу. А сжимают газ при более низкой температуре, когда давление газа меньше. Поэтому для того, чтобы вернуть газ в начальное состояние, внешние силы должны совершить меньшую работу.
Рассмотрим пример.
? 12. Газ совершает циклический процесс: переходит из состояния 1 в состояние 2 (рис. 42.9), а потом возвращается в состояние 1. При этом объем газа не должен быть меньше начального и больше конечного.
а) Какую максимально возможную работу может совершить газ при переходе 1–2, если давление газа не должно превышать 3p0?
б) Какую минимально возможную работу должны совершить внешние силы при переходе 2–1, если давление газа не должно быть меньше p0?
в) Насколько в этом случае работа газа при циклическом процессе больше работы внешних сил?
Применение первого закона термодинамики к изопроцессам и адиабатному процессу
? 13. Используя первый закон термодинамики, а также выражения для внутренней энергии и работы газа, объясните, почему:
а) при изохорном процессе Aг = 0, Q = ∆U, то есть сообщенное газу количество теплоты (напомним, что оно может быть как положительным, так и отрицательным) равно изменению внутренней энергии газа;
б) при изотермическом процессе ∆U = 0, Q = Aг, то есть сообщенное газу количество теплоты равно работе газа;
в) при изобарном процессе Aг ≠ 0, ∆U ≠ 0;
г) при адиабатном процессе Q = 0, Aг = –∆U, то есть при расширении газ совершает работу за счет уменьшения внутренней энергии, а при сжатии газа его внутренняя энергия увеличивается за счет работы внешних сил.
Подсказка. Если давление не изменяется, то ∆(pV) = p∆V.
Дополнительные вопросы и задания
14. На рисунках 42.10, а, б, в изображены графики трех процессов с данной массой одноатомного идеального газа. Чему равно изменение внутренней энергии газа для каждого из этих процессов при переходе 1–2?
15. При изобарном расширении данной массы одноатомного идеального газа его температура возросла от 0 ºС до 100 ºС. При этом газу было передано количество теплоты, равное 5 кДж.
а) Насколько изменилась внутренняя энергия газа?
б) Чему равно количество вещества в сосуде с газом?
Внутренняя
энергия и способы ее изменения
U
– внутренняя энергия — это
энергия движения и взаимодействия
частиц, из которых состоит тело.
Внутренняя энергия зависит от температуры
тела, его агрегатного состояния
(газообразное, жидкое, твердое), от
химических, атомных
и ядерных
реакций.
Она не зависит ни от механического
движения тела, ни от положения этого
тела относительно других тел.
U=Ек+Еп
Т.к.
у идеального газа отсутствуют силы
притяжения молекул, то Еп=0, следовательно
U=Ек=3/2*КТ
– для одноатомного газа; U=Ек=5/2*КТ
– для 2х-атомного; U=Ек=7/2*КТ
– для 3х-атомного.
Внутреннюю
энергию идеального газа можно выразить
через термодинамические параметры:
U=3/2*PV
Внутреннюю
энергию газа можно изменить двумя
способами:
1.
Путем теплообмена.
2.
Путем совершения работы.
Работа
газа в изопроцессах.
А=P*ΔV=[Дж]
1.Изотермический.
Т=const
, m=const
Уравнение
изопроцесса: P*V=const
Формула
работы в изопроцессе: A=
а)
изотермическое расширение: V1<V2
б)изотермическое
сжатие: V1>V2
2.Изобарический.P=const,
m=const
Уравнение
изопроцесса:
Формула
работы в изопроцессе: A=P*∆V
При
изобарическом расширении: V2
>V1,
∆V=(V2-V1)>0,
A>0
При
изобарическом сжатии:
V2
<V1,
∆V<0,
A<0
3.Изохорический.V=const,
m=const
Уравнение
изопроцесса:
Формула
работы в изопроцессе:A=p*∆V=0
– газ работу не совершает
23.
-
Первый
закон термодинамики.Первый
закон термодинамики (закон сохранения
энергии для тепловых процессов)
определяет количественное соотношение
между изменением внутренней энергии
системы дельта U, количеством теплоты
Q, подведенным к ней, и суммарной работой
внешних сил A, действующих на систему.Первый
закон термодинамики — количество
теплоты, подведенное к системе, идет
на изменение ее внутренней энергии и
на совершение системой работы над
внешними телами:Q=∆U+A.Применение
первого закона термодинамики к
изопроцессам.При
изохорном процессе
объем газа остается постоянным, поэтому
газ не совершает работу. Изменение
внутренней энергии газа происходит
благодаря теплообмену с окружающими
телами:Q=∆U.При
изотермическом
процессе количество теплоты, переданное
газу от нагревателя, полностью
расходуется на совершение работы:Q=A
При
изобарном процессе кол- во газа
подведенное к нему количество теплоты
расходуется как на увеличение его
внутренней энергии и на совершение
работы газом:Q=∆U+A
Адиабатный
процесс — термодинамический процесс в
теплоизолированной системе. Q=A.Второй
закон термодинамики (необратимость
процессов в природе).Формулировка: Все
процессы в природе необратимы, т.е
самопроизвольно протекают только в
одном направлении.Обратимым называется
процесс, который отвечает следующим
условиям:
1. его
можно провести в двух противоположных
направлениях;
2. в
каждом из этих случаев система и
окружающие ее тела проходят через одни
и те же промежуточные состояния;
3. после
проведения прямого и обратного процессов
система и окружающие ее тела возвращаются
к исходному состоянию.
Необратимым-это
процессы самопроизвольно протекающие
только в одном направлении.
При
изобарном
процессе кол- во газа подведенное к
нему количество теплоты расходуется
как на
24.
Принцип действия теплового двигателя.
КПД теплового двигателя. Цикл Карно.
ДВС—
это машина в которой внутренняя энергия
топлива превращается в механическую
работу.
—ДВС +ДВС
1.Низкий
КПД 1.Топливо содержит гораздо больше
энергии, чем лучшие
2.Сильный
шум электрические аккумуляторы.
3.Токсичные
выбросы
4.Меньший
ресурс
4-х
тактный ДВС
Такты
работы:
1.Впуск(поршень
движется вниз и открывается впускной
клапан)
2.Сжатие(поршень
поднимается вверх, сжимает горючую
смесь, значит давление увеличивается
=> температура увеличивается)
3.Рабочий
цикл(при проскакивании искры смесь
воспламеняется, давление ещё больше
увеличивается и внутренняя энергия
газа превращается в механическую
работу;газы давят на поршень и он
движется вниз)
4.Выпуск(поршень
движется вверх, открывается выпускной
клапан, переработанные газы выбрасываются
в атмосферу(холодильник)).
Любой
тепловой двигатель имеет 3 неотъемлемые
части:
1.Нагреватель
2.Рабочее
тело
3.Газ
или пар
4.Холодильник(атмосфера).
КПД
теплового двигателя.
Отношение
работы к энергии, которое получило
рабочее тело от нагревателя, называют
коэффициентом полезного действия
(КПД):
Паровая или газовая турбина, двигатель
внутреннего сгорания, реактивный
двигатель работают на базе ископаемого
топлива. В процессе работы многочисленных
тепловых машин возникают тепловые
потери, которые в конечном счете приводят
к повышению внутренней энергии атмосферы,
т. е. к повышению ее температуры. Это
может привести к таянию ледников и
катастрофическому повышению уровня
Мирового океана, а вместе с тем к
глобальному изменению природных
условий. При работе тепловых установок
и двигателей в атмосферу выбрасываются
вредные для человека, животных и растений
оксиды азота, углерода и серы. С вредными
последствиями работы тепловых машин
можно бороться путем повышения КПД, их
регулировки и создания новых двигателей,
не выбрасывающих вредные вещества с
отработанными газами.
Цикл
Карно.
—
это замкнутый
цикл который
состоит из 2-х изотерм и 2-х адиобат.
Если
двигатель будет работать, то получается
максимальное КПД
КПД=Smax
=
T1-
это температура нагревания
T2-
это температура холодильника
Smax=
Q1-
это тепло, которое получает рабочее
тело от нагревателя
Q2-
это тепло, которое отдает рабочее тело
холодильнику.
КПД≠100%,
т.к. 100% можно было бы получить тогда,
когда температура холодильника равнялась
0К.
1→2
Изотермическое расширение. Т=const,
m=const,
V1<V2,∆U=0,
U=const,
A>0,
Q
подводим.
2→3
Адиаботическое расширение. Q=0,
V2<V3,
газ отдает часть энергии => ∆U↓
и T1↓
до Т2
3→4
Изотермическое сжатие.Т2=const,
∆U=0,
A<0,
Q
отводится.
4→1
Адиабатическое сжатие. Q=0,
U↑,
T↑
до Т1
25.Адиабат.
называют процесс,
Протекающий,
без теплообмена
с
окружающей средой. Q = 0,
следовательно,
газ при расширении
совершает
работу за счет уменьше-
-ния
его внутренней энергии,
следовательно,
газ охлаждается
,
Кривая,
изображающая
адиабатный
процесс, называется адиабатой.
Есл
воздух насыщен паром,то измен P,V,T
Происход
медленно а в сухом за счёт
Водяного
пара внутри Vвыделят
тепло.
При
насыщенной t,
Растёт
медленнее чем в сухом.
В
атмосфере при подъёме воздуха
Происходит
его расшир.
Адиаб.процесс
применяют при работе
Холод.и
мороз.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
17.05.2015430.93 Кб191.pdf
- #
- #
Тема
урока: Внутренняя энергия идеального газа.
Способы изменения внутренней энергии
Тип
урока: изучение нового материала.
Вид
урока: урок теоретического исследование.
Методы
урока: информационно-развивающий,
проблемно-поисковый, частично-поисковый, наглядный, словесный, ИКТ.
Форма
работы: работа в микрогруппах, самостоятельная
работа с презентацией, фронтальная, индивидуальная.
Комплексно-методическое
обеспечение: интерактивный экран, ноутбук,
презентация, оценочный лист для студентов, раздаточный материал, опорный
конспект, жетоны.
Демонстрации: видеоролика
«Внутренняя энергия идеального газа» «Эксперимент по
сравнению теплопроводности серебра, меди и железа», «Конвекционные потоки при
нагревании воды», «Излучение тел с темной и светлой поверхностью».
Межпредметная
связь: математика, химия, биология.
Цель урока:
Образовательная: познакомить
с понятием внутренней энергии идеального газа и способами изменения внутренней
энергии.
Развивающая:
умения анализировать факты при наблюдении явлений, осуществлять самооценку
своей учебной деятельности, определять эффективность своего труда, навыки
работы с опорными конспектами.
Воспитательная:
воспитывать чувство коллективизма, сопереживания, культуры поведения,
познавательного интереса к предмету, что приводит к положительной мотивации.
Задачи
урока: продолжить
формирование умений наблюдать и делать выводы на основе этих наблюдений,
выделять главное, развивать мотивацию изучения физики; формировать умения
объяснять физические явления в природе и в быту.
План
урока:
1.
Организационный
момент.
2.
Проверка
домашнего задания
3.
Изучение
нового материала.
4.
Закрепление
материала.
5.
Домашнее
задание.
6.
Рефлексия.
Ход
урока.
1
Этап. Организационный момент.
Дидактическая
задача: настроить студентов на самостоятельную
работу
В течении урока заработать как можно больше жетонов,
для этого вы должны быть внимательными и правильно отвечать на вопросы. По
итогу занятия – выставим оценки.
2.
Этап.
Проверка домашнего задания.
Но прежде повторим материал, необходимый для изучения
новой темы.
– Материал повторим устно, за исключением
нескольких ребят, которые будут работать по карточкам письменно.
Вопросы для работы по карточкам:
1)
Какие тепловые явления вы знаете?
2)
Мерой чего является температура тела?
3)
Какие виды жидкостных термометров вы знаете?
4)
Какое движение называется тепловым?
5)
Когда и кем был изобретён первый термометр?
На уроках физики мы
рассматриваем различные явления. Перед вами некоторые из них. Найдите лишнее в
каждом списке? Почему вы так считаете?
1. Летит мяч, плывёт
корабль, нагревается утюг, капают капли дождя.
2. Тает снег, горят
дрова, летит птица, кипит вода в чайнике.
Девиз нашего урока на экране: «Вопросы – это
ключи к познанию!»
1.
Какие
физические явления мы сейчас изучаем? (тепловые)
2.
Что
такое тепловые явления? ( —процессы связанные с изменением температуры
вещества). Приведите примеры.
3.
Какая
величина характеризует тепловое состояние тел?
4.
Как
называется наука, которая изучает тепловые явления? (МКТ и Термодинамика)
5.
В
чем суть положение МКТ? (все тела состоят из мельчайших частиц — молекул (а
молекулы, в свою очередь, из атомов); молекулы беспорядочно движутся; между
молекулами существуют силы притяжения и отталкивания. Молекулярная физика
учитывает строение вещества, т.е. из чего состоит вещества.
6.
Что
такое молекулы? (- наименьшая частица вещества).
7.
Что
такое атомы? (химически неделимые частицы, из которых состоят молекулы).
8.
Какие
виды энергии вам известны? (кинетическая и потенциальная энергия)
9.
Что
называется кинетической энергией? Какими признаками обладает она?
(-энергия, которой обладают тела
вследствие своего движения).
10.
Что
называется потенциальной энергией взаимодействующих тел? Какими признаками обладают
она? (-энергия, которая зависящая от взаимного расположения тел).
Изучение
нового материала.
А. Понятие внутренняя энергия тела и
внутренняя энергия идеального газа.
Опыт: Опишите превращение энергии.
1.
Какой энергией обладает свинцовый шарик
поднятый на некоторую высоту?
2.
Как изменяется его энергия при падении
вниз?
3.
Какой энергией обладал шарик
непосредственно перед ударом?
4.
Какие изменения происходят с мячиком и с
поверхностью?
5.
Куда исчезла первоначальная энергия шарика
при приземлении?
6.
Какие изменения произошли в движении и
расположении молекул мячика?
Вывод: изменилась
потенциальная энергия взаимодействия частиц (молекул) из которых состоит тело.
Вывод: изменилась
кинетическая энергия частиц (молекул) из которых состоит тело.
– Куда исчезла механическая энергия? (Перешла во
кинетическую и потенциальную энергии молекул).
Как вы думаете, что мы получим, если сложим все
кинетические и потенциальные энергии молекул тела? (Эти энергии и составляют
внутреннюю энергию тела).
Энергия движения и взаимодействия частиц,
из которых состоит тело, называется внутренней энергией.
Любое тело обладает внутренней энергией.
Одна из главных величин, используемых в решение задач
в термодинамике. Внутренняя энергия обозначается буквой U латинского алфавита и
измеряется также как и механическая энергия в Джоулях.
На основание формулировки внутренняя энергия
напишите её формулу для макроскопического тела?
Каждый из вас обладает внутренней энергией, так как
способен совершить работу, например, по передвижению любого предмета,
находящегося у вас на парте, но вы не обладаете механической энергией, так как
покоитесь относительно Земли.
Работая, вы растрачиваете вашу внутреннюю энергию, а
как вы её восполняете? Вот некоторые сведения, полезные для поддержания вашего
здоровья «на уровне». Поглощая пищу, вы потребляете содержащуюся в ней
внутреннюю энергию в следующих количествах: хлеб – 9000 Дж/г, сахар – 17000
Дж/г, масло – 33000 Дж/г.
Работая, вы расходуете энергию в следующих
примерно количествах (за 60 мин на 1 кг массы человека): при зарядке – 16 000
Дж, при ходьбе – 15 000 Дж, при лежании – 4000 Дж. Внесистемная
единица калория 1 кал=4,2 Дж, 1 ккал – 4200 Дж.
На завтрак вы съели 100г хлеба с 5 г масла и выпили
чай с 10 г сахара. Сколько времени вам при весе 60 кг нужно будет заниматься
зарядкой, чтобы жир не отложился.
Не
израсходованная энергия запасается в жировом слое.
Внутренняя энергия идеального газа.
Учитель: Выясним чему равна внутренняя энергия идеального газа?
1.
Что
является объектом изучение в термодинамике? (идеальный газ)
2.
Что
такое идеальный газ (Идеальный газ – модель идеального газа, в
котором взаимодействие между молекулами можно не учитывать.)
3.
Для
того чтобы описать состояние идеального газа используют три термодинамических
параметра. Какие? (давление, температура и объём).
4.
Каким
уравнением взаимосвязаны все три параметра? (уравнение Менделеева
–Клапейрона).
5.
Как
и чем создаётся давление газа? (число ударов молекул).
В идеальном газе пренебрегают двумя
параметрами:
1) размером молекулы 2) взаимодействие между
молекулами. По сути идеальный газ – газ невзаимодействующих молекул.
В идеальном газе , то внутренняя
энергия идеального газа определяется только кинетической беспорядочного
движения молекул.
Внутренняя энергия идеального газа –
кинетическая энергия движения частиц. (т.к энергией взаимодействия частиц
пренебрегаем).
N (1) .
Внутреннюю энергию можно вычислить через среднюю кинетическую энергию
поступательного движения и количество молекул в данном теле.
Вывод формулы внутренней энергии идеального газа.
(2) кинетическая
энергия поступательного движение газа
— ( 3) количество молекул
в данном теле
(3,2)
R=
k
–
Учитель: От какого
макроскопического параметра зависит внутренняя энергия идеального газа?
внутренняя энергия идеального газа прямо, пропорциональна его абсолютной
температуре.
Из этой формулы следует, что внутренняя энергия
идеального газа зависит от температуры, это значит, при нагревании внутренняя
энергия возрастает т.к. скорость движении молекул увеличиться, а при охлаждении
она уменьшается.
Особенностью внутренней энергии является то, что она
всегда больше нуля, ведь тепловое движение частиц никогда не прекращается. При
этом величина внутренней энергии не зависит от механической энергии тела.
Молекулы
реальных газов имеют сложную форму. Внутренняя энергия зависит от числа
степеней свободы.
Просмотр видео
урока «Внутренняя энергия идеального газа».
Работа в группе.
Вопросы. (какая группа первой поднимет руку, если правильно
ответить на вопросы они заработают жетоны).
1.
i-обозначение
какой величины? (число степени свободы молекул газа)
2.
Что такое степени свободы? (-число
возможных свободных движений частиц. Параметр соответствующей к каждой молекул
газа. Возможное направление движений молекул).
3.
От чего зависит число степеней свободы?
(От возможного направления движения молекул).
Влияет ли число атомов на распределение энергии по
степеням свободы? (Да. Число атомов в молекуле вещества влияет на распределение
энергии по степеням свободы. На каждую степень свободы движения молекул в
среднем приходится 1/2кТ энергии.)
4.
В зависимости от i
сколько типов газов существует в природе? Какие? (3)
5.
Какие виды движения рассмотрены для
определения числа степеней для 1-го, 2-х, и многоатомных газов (
поступательное, вращательное)
6.
Какой вид движение не учитывают в
идеальном газе? (колебательное движение атомов в молекулах нет).
Одноатомный газ
— газ, молекулы которого состоят из одного единственного атома. Т.е. количество
атомов 1. К ним относятся, например, инертные газы: гелий He, неон Ne, аргон
Ar и т.п.
Двухатомный газ
– газ, молекулу которого состоят из двух атомов, количество атомов 2. Такие
газы, как водород H2, азот N2, кислород O2
Многоатомный газ —
газ, молекулы которого состоят из трех и более атомов. т.е. количество атомов
>> 3. Например: молекула углекислого газа
CO2 состоит из трех молекул, озона О3, водяного пары Н2О..
Для одноатомных газов i = 3, для двухатомных i = 5 и
для многоатомных газов i=6 т.д.
Следующие формулы написаны для одноатомных газов (для
многоатомных следует число 3 заменить на соответствующее числу степеней свободы
для молекул данного газа i):
Внутренняя
энергия идеального газа для одноатомного идеального газа.
Внутренняя
энергия для двухатомного газа.
для многоатомного
газа
Заполните таблицу.
|
газ |
одноатомный |
2-хатомный |
3-хатомный |
|
|
Число степеней |
поступательное |
3 |
3 |
3 |
|
вращательное |
— |
2 |
3 |
|
|
всего |
3 |
5 |
6 |
|
|
Формула |
ФИЗМИНУТКА. Сейчас каждая группа покажет характер
движения молекул.
Все тела состоят из трех агрегатных состояний.
Показать характер движения молекул в твердых, жидких и газообразных состояниях.
Твердое – колебание около положения равновесия.
Жидкое состояние вещества – в основном колеблются
около положения равновесия, изредка перескакивая в другое.
Газообразное состояние вещества – хаотическое движение
с многочисленными столкновениями.
Способы изменения внутренней энергии
Проблемный вопрос: как можно изменить внутреннюю
энергию тела?
Вторая часть нашей работы: необходимо выяснить, как
можно изменить внутреннюю энергию тела.
Из формулы следует, что изменить внутреннюю энергию
данного тела можно изменением температуры тела т.е. осуществить процесс
теплопередачи. В процессе теплопередачи телу сообщается некоторое количество
теплоты.
Попробуйте объяснить значение слова «теплопередача»
(слово «теплопередача» подразумевает передачу тепловой энергии).
Теплопередача — процесс
изменения внутренней энергии при теплообмене без совершения работы.
Существует три способа передачи теплоты. Какие –
отгадайте ребусы.
Теплопроводность — перенос
энергии от более нагретых участков тела к менее нагретым в результате теплового
движения и взаимодействия частиц.
Конвекция – это перенос
энергии струями жидкости или газа.
Излучение — перенос
энергии в виде электромагнитных волн
Способы изменения
внутренней энергии (самостоятельно изучают тему в микро группе).
Вы должны выбрать из всей предложенной информации
презентации, которая относятся к вашему вопросу.
А
потом защитить знания. Защита знаний будет «Делегат», «Выбор», «Все все»
Лидеры тянут билеты, на обратной стороне которых
имеются соответственно 3 надписи. Они обозначают:
“Делегат” — группа
выставляет одного делегата, который защищает тему всей группы..
“Выбор” — учитель сам назначает
студента, который будет отвечать.
“Все все” — каждый член
микрогруппы должен ответить новый материал.
Самостоятельно изучите этот вопрос. (3 мин – Выбрать
информацию и 5 мин на подготовку) . Из рисунка можно взять информацию.
СПОСОБЫ ИЗМЕНЕНИЯ ВНУТРЕННЕЙ ЭНЕРГИИ
(презентация)
1.
ТЕПЛОПРОВОДНОСТЬ
Ответьте
на вопросы: (слайд 4)
1.
Что произойдет, если в горячий чай опустим холодную ложку? (Через некоторое
время она нагреется).
2.
Почему холодная ложка нагрелась? (Чай отдал часть своего тепла ложке, а часть
окружающему воздуху).
Вывод:
Из примера ясно, что тепло может передаваться от тела, более нагретого к телу
менее нагретому (от горячей воды к холодной ложке). Но энергия передавалась и
по самой ложке – от ее нагретого конца к холодному.
3.
В результате чего происходит перенос тепла от нагретого конца ложки к
холодному? (В результате движения и взаимодействия частиц)
Нагревание
ложки в горячем чае — пример теплопроводности.
Теплопроводность
– перенос энергии от более нагретых участков тела к менее нагретым, в
результате теплового движения и взаимодействия частиц.
Объясните
опыт
К медной проволоке с помощью пластилина прикреплены
кнопки. Будем нагревать конец проволоки свечей или на пламени спиртовки.
Вопросы: (слайд 4)
1. Что наблюдаем? (Гвоздики начинают постепенно один
за другим отпадать, сначала те, которые ближе к пламени).
2. Как происходит передача тепла? (От горячего конца
проволоки к холодному).
3. Как долго будет происходить передача тепла по
проволоке? (Пока проволока вся не нагреется, т. е пока температура во всей
проволоке не выровняется)
4. Что можно сказать про скорость движения молекул на
участке, расположенном ближе к пламени? (Скорость движения молекул
увеличивается)
5. Влияет ли расстояние между молекулами на скорость
передачи тепла? (Чем меньше расстояние между молекулами, тем с большей
скоростью идет перенос тепла)
6. Вспомните расположение молекул в твердых телах,
жидкостях и газах. В каких телах процесс переноса энергии будет происходить
быстрее? (Быстрее в металлах, затем в жидкостях и газах).
(Слайд 7)
Плохой теплопроводностью обладают шерсть, волосы,
перья птиц, бумага, пробка и другие пористые тела. Это связано с тем, что между
волокнами этих веществ содержится воздух. Самой низкой теплопроводностью
обладает вакуум (освобожденное от воздуха пространство).
Запишем основные особенности теплопроводности: (слайд
8)
в твердых телах, жидкостях и газах;
само
вещество не переносится;
приводит
к выравниванию температуры тела;
разные
тела – разная теплопроводность
Примеры
теплопроводности: (слайд 10-11)
1. Снег — пористое, рыхлое вещество, в нем содержится
воздух. Поэтому снег обладает плохой теплопроводностью и хорошо защищает землю,
озимые посевы, плодовые деревья от вымерзания.
2. Кухонные прихватки сшиты из материала, который
обладает плохой теплопроводностью. Ручки чайников, кастрюль делают из
материалов обладающих плохой теплопроводностью. Все это защищает руки от
ожогов, при прикосновении к горячим предметам.
3. Вещества с хорошей теплопроводностью (металлы)
используют для быстрого нагревания тел или деталей.
2.
КОНВЕКЦИЯ
Отгадайте
загадки:
1)
Загляните под окошко –
Там
растянута гармошка,
Но
гармошке не играет –
Нам
квартиру согревает… (батарея)
Батареи, печи, радиаторы отопления используются
человеком для обогрева жилых помещений, а точнее нагревания воздуха в них.
Происходит это благодаря конвекции – следующему виду теплопередачи.
Конвекция – это перенос энергии струями жидкости или
газа. (Слайд 12)
Попробуем объяснить, как происходит конвекция в жилых
помещениях.
Воздух, соприкасаясь с батареей, от нее нагревается,
при этом он расширяется, его плотность становится меньше плотности холодного
воздуха. Теплый воздух, как более легкий, поднимается вверх под действием силы
Архимеда, а тяжелый холодный воздух опускается вниз.
Затем снова: более холодный воздух доходит до батареи,
нагревается, расширяется, становится легче и под действием Архимедовой силы
поднимается вверх и т.д.
Благодаря такому движению воздух в комнате прогревается.
Точно также происходит нагревание жидкости. Посмотрите
эксперимент по наблюдению конвекционных потоков при нагревании воды (с помощью
марганцовки). (Слайд 14)
Обратите внимание, что в отличие от теплопроводности,
при конвекции происходит перенос вещества и в твердых телах конвекция не
происходит.
Различают два вида конвекции: естественную и
вынужденную.
Нагревание жидкости в кастрюле или воздуха в комнате –
это примеры естественной конвекции. Для ее возникновения вещества нужно
нагревать снизу или охлаждать сверху. Почему именно так? Если нагревать будем
сверху, то куда будут перемещаться нагретые слои воды, а куда холодные? (Ответ:
никуда, так как нагретые слои и так уже наверху, а холодные слои так и
останутся внизу)
Вынужденная конвекция наблюдается, если жидкость
перемешивать ложкой, вентилятором, миксером.
Особенности конвекции: (слайд 15)
возникает в жидкостях и газах, невозможна в твердых
телах и вакууме;
само вещество переносится;
нагревать вещества нужно снизу.
Примеры конвекции: (слайд 16-17)
1) холодные и теплые морские и океанические течения,
2) в атмосфере, вертикальные перемещения воздуха
приводят к образованию облаков;
3) охлаждение или нагревание жидкостей и газов в
различных технических устройствах, например в холодильниках и др.,
обеспечивается водяное охлаждение двигателей внутреннего сгорания.
3. ИЗЛУЧЕНИЕ
(Слайд 18)
Всем известно, что Солнце основной источник тепла на
Земле. Земля находится от него на расстоянии 150 млн. км. Как передается тепло
от Солнца на Землю?
Между Землей и Солнцем за пределами нашей атмосферы
все пространство – вакуум. А нам известно, что в вакууме теплопроводность и
конвекция происходить не могут.
Каким способом происходит передача тепла? Здесь
осуществляется еще один вид теплопередачи – излучение.
Почему этот вид теплопередачи является единственно
возможным передачи солнечной энергии на поверхность Земли?
Излучение – это теплообмен, при котором энергия
переносится электромагнитными лучами.
Отличается от теплопроводности и конвекции тем, что
теплота в этом случае может передаваться через вакуум.
Посмотрите видеофрагмент об излучении (слайд 19).
Излучают энергию все тела: тело человека, печь,
электрическая лампа.
Чем выше температура тела, тем сильнее его тепловое
излучение.
Тела не только излучают энергию, но и поглощают ее.
(слайд 20) Причем темные
поверхности лучше поглощают и излучают энергию, чем тела, имеющие светлую
поверхность.
Особенности излучения (слайд 21):
происходит в любом веществе;
чем выше температура тела, тем интенсивнее излучение;
происходит в вакууме;
темные тела лучше поглощают излучение, чем светлые и
лучше излучают.
Примеры использования излучения тел (слайд 22):
Поверхности ракет, дирижаблей, воздушных шаров,
спутников, самолётов, окрашивают серебристой краской, чтобы они не нагревались
Солнцем. Если наоборот надо использовать солнечную энергию, то части приборов
окрашивают в темный цвет.
Люди зимой носят темные одежды (черного, синего,
коричного цвета) в них теплее, а летом светлые (бежевые, белые цвета). Грязный
снег в солнечную погоду тает быстрее, чем чистый, потому что тела с темной
поверхностью лучше поглощают солнечное излучение и быстрее нагреваются.
– С какими видами теплопередачи мы познакомились?
– Определите, какой из видов теплопередачи играет
основную роль в следующих ситуациях:
а) нагревание воды в чайнике (конвекция);
б) человек греется у костра (излучение);
в) нагревание поверхности стола от включенной
настольной лампы (излучение);
г) нагревание металлического цилиндра, опущенного в
кипяток (теплопроводность).
7.
Этап
.Закрепление полученных знаний на примерах задач «Своя игра», (слайды 23-29).
Перед вами игровое поле с шестью заданиями, вы можете
выбрать любое.
1. В каком доме теплее зимой, если толщина стен
одинакова? Теплее в деревянном доме, так как дерево содержит 70% воздуха, а
кирпич 20%. Воздух — плохой проводник тепла. В последнее время в строительстве
применяют «пористые» кирпичи для уменьшения теплопроводности.
2. Каким способом происходит передача энергии от
источника тепла к мальчику?
Мальчику, сидящему у печки, энергия в основном
передается теплопроводностью.
3. Каким способом происходит передача энергии от
источника тепла к мальчику?
Мальчику, лежащему на песке, энергия от солнца
передается излучением, а от песка теплопроводностью.
4. В каком из этих вагонов перевозят скоропортящиеся
продукты? Почему?
Скоропортящиеся продукты перевозят в вагонах,
окрашенных в белый цвет, так как такой вагон в меньшей степени нагревается
солнечными лучами.
5. Почему водоплавающие птицы и другие животные не
замерзают зимой?
6. Почему оконные рамы делают двойными?
Между рамами содержится воздух, который обладает
плохой теплопроводностью и защищает от потерь тепла.
Разгадайте кроссворд (слайд 31):
1. Величина, от которой зависит интенсивность излучения.
2. Вид теплопередачи, который может осуществляться в
вакууме.
3. Процесс изменения внутренней энергии без совершения
работы над телом или самим телом.
4. Основной источник энергии на Земле.
5. Смесь газов. Обладает плохой теплопроводностью.
6. Процесс превращения одного вида энергии в другой.
7. Металл, имеющий самую хорошую теплопроводностью.
8. Разреженный газ.
9. Величина, обладающая свойством сохранения.
10. Вид теплопередачи, который сопровождается
переносом вещества.
Разгадав кроссворд, вы получили еще одно слово,
которое является синонимом к слову «теплопередача» – это слово… («теплообмен»).
«Теплопередача» и «теплообмен» – одинаковые по смыслу слова. Используйте их
заменяя одно другим.
РЕФЛЕКСИЯ
Продолжите фразы:
Сегодня я узнал…..
Я научился……..
Я понял, что……
ДОМАШНЕЕ ЗАДАНИЕ
1.
Выучить конспект.
2.
Преобразовать формулу .
Выучить обозначение физических величин и единицы
измерение.
3.
Решить задачи.
4.
Доклад, презентацию «Теплопередача в
природе и технике», ребусы, кроссворды.
Рабочий лист
Вопросы
1.
i-обозначение какой величины?
2.
Что такое степени свободы?
3.
От чего зависит число степеней свободы?
4.
Влияет ли число атомов на распределение
энергии по степеням свободы?
5.
В зависимости от i сколько типов газов существует
в природе? Какие?
6.
Какие виды движение рассмотрены для
определение число степеней для 1-го, 2-х, и многоатомных газов
7.
Какой вид движение не учитывают в
идеальном газе?
8.
Заполните таблицу
|
газ |
движение |
одноатомный |
2-хатомный |
3-хатомный |
|
Число |
поступательное |
|||
|
вращательное |
||||
|
всего |
||||
|
Формула |
Рабочий лист
1.
i-обозначение какой величины?
2.
Что такое степени свободы?
3.
От чего зависит число степеней свободы?
4.
Влияет ли число атомов на распределение
энергии по степеням свободы?
5.
В зависимости от i сколько типов газов
существует в природе? Какие?
6.
Какие виды движение рассмотрены для
определение число степеней для 1-го, 2-х, и многоатомных газов
7.
Какой вид движение не учитывают в
идеальном газе?
8.
Заполните таблицу
|
газ |
движение |
одноатомный |
2-хатомный |
3-хатомный |
|
Число |
поступательное |
|||
|
вращательное |
||||
|
всего |
||||
|
Формула |
Зачетная
работа . По теме «Внутренняя энергия»
1.
Преобразовать формулы, применить, готовы
формулы во время решение задачи.
|
Формула |
Выразить |
Формула |
Выразить |
|
|
T= |
|
P= |
|
|
|
|
V= |
РЕШЕНИЕ
ЗАДАЧ.
Соблюдение
алгоритма решения (дано, СИ, формула, вычисления, проверка по размерности,
ответ).
1.
Рассчитайте внутреннюю энергию
одноатомного идеального газа в количестве 3 моль при температуре
2.
При
нагревании аргона, количество вещества которого 2 моля, внутренняя энергия
увеличилась на 250Дж. Каково изменение температуры аргона?
3.
Одноатомный идеальный газ занимает объем 5
л и имеет давление 200 кПа. Какова его внутренняя энергия?
4.
Каково давление одноатомного идеального
газа, занимающего объем 2л, если его внутренняя энергия равна 300Дж.
5.
Какой объем занимает одноатомный идеальный
газ, если при нормальном атмосферном давлении его внутренняя энергия равен 600
Дж.
6.
Какова внутренняя энергия идеального газа,
находящегося в закрытом сосуде объемом 1,5 л при температуре , если
концентрация молекул ?
7.
Воздух массой 87 кг нагревается от 10° С
до 30° С Определите изменение внутренней энергии воздуха. Молекулярную массу
воздуха следует принять равной 2,9 кг/моль,
а воздух считается двухатомным (идеальным) газом.
8.
Определить внутреннюю энергию 10 молей
азота при температуре 470 С.
9.
Определить внутреннюю энергию 6 кг
кислорода при температуре 1270 С.
10.
Определить внутреннюю энергию азота,
находящегося в баллоне 6 л при давлении 200кПа.
11.
Определить внутреннюю энергию кислорода
плотностью 1,2 кг/м3 в объеме 3 л при температуре 120 С.
12.
Какова внутренняя энергия 6 кг гелия
при температуре 670 С.
13.
Определить
внутреннюю энергию 5 молей неона при температуре 00 С.
14.
Чему
равна внутренняя энергия водяного пара при температуре 1000 С, если
он создает в 3 л баллоне давление 8 МПа?
15.
Сравнить внутреннюю энергию кислорода и
гелия, содержащих одинаковую массу и имеющих равную температуру.
16.
На
сколько изменится внутренняя энергия одного моля одноатомного газа при его
нагревании на 100К ?
17.
Какова
температура одноатомного идеального газа, если известно, что внутренняя энергия
2 моль составляет 831 кДж?
18.
Найдите
концентрацию молекул идеального газа в сосуде вместимостью 2л при температуре , если внутренняя
энергия равна 300Дж.
19.
В
стальном газе находится гелии массой 0,5 кг при температуре . Как измениться
внутренняя энергия, если его температура повысится до .
Тест по теме «Внутренняя энергия
идеального газа»
1-Вариант.
1.
Газ, взаимодействие между молекулами которого пренебрегаем…
А.
Реальный. Б. Идеальный . В.
Свободный.
2.
Как называются явления, обусловленные изменением температуры тела?
А.
Тепловые Б. Электрические. В.
Магнитные.
3.
Значение температуры по шкале Кельвина определяется:
А.T=t— 273
Б.T=273t В.T=t+273
4.
Внутренняя энергия идеального газа зависит от
А.
Температуры. Б. Формы тела С. Агрегатного
состояния вещества.
5.
Внутреннюю энергию тела составляют
А.
Только потенциальная энергия всех молекул
Б.
только кинетическая энергия всех молекул
В.
Потенциальная и кинетическая энергия всех молекул.
6.
Одноатомный газ имеет число степеней
А.
3 Б. 5
В.6
7.
Внутреннюю энергию идеального газа составляют
А.
Только потенциальная энергия всех молекул
Б.
только кинетическая энергия всех молекул
В.
Потенциальная и кинетическая энергия всех молекул.
8.
Внутренняя энергия многоатомного газа
А.
Б.
В.
9.
Внутренняя энергия измеряется
А.
Па Б. Дж
В. Н
10.
Внутренняя энергия реального газа зависит
А.
Температуры Б. объема В.
Температуры, объема.
11.
В
металлическую кружку налита вода. Какое из перечисленных ниже действий приводит
к изменению внутренней энергии воды?
А.
Нагревание воды на горячей плите.
Б.
Приведение воды в поступательное движение вместе с кружкой.
В.
Совершение работы над водой: перемешивание ее миксером.
12.
Сковорода стоит на горячей плите. Каким способом происходит в основном
теплопередача от внешней поверхности сковороды к ее внутренней поверхности?
А.
Теплопроводностью.
Б.
Конвекцией.
В.
Излучением.
Тест по теме «Внутренняя энергия идеального
газа»
Вариант -2
1.
В идеальном газе пренебрегаем
А.
Взаимодействие между молекулами
Б.
Температурой
В.
Количество молекулами.
2.
Внутренняя энергия измеряется
А.
Па Б. Н В.
Дж
3.
Внутреннюю энергию тела составляют
А.
Только потенциальная энергия всех молекул
Б.
только кинетическая энергия всех молекул
В.
Потенциальная и кинетическая энергия всех молекул.
4.
Внутренняя энергия одноатомного газа
А.
Б.
В.
5.
Двухатомный газ имеет число степеней
А.
3 Б. 5 В.6
6.
Внутренняя энергия идеального газа не учитывает
А.
Кинетическую энергию Б. Потенциальную энергию
В.
Механическую энергию.
7.
Значение температуры по шкале Кельвина определяется:
А.T=t+ 273
Б.T=273t В.T=t-273
8.
Внутренняя энергия реального газа зависит
А.
Температуры Б. объема В.
Температуры, объема.
9.
В идеальном газе внутренняя энергия равна……..
А)
сумме кинетических и потенциальных энергии всех молекул,
Б)
сумме кинетических энергий всех молекул,
В)
сумме потенциальных энергии всех молекул.
10.
Какой вид теплопередачи проявляется когда: кошка греется на солнышке.
А)
конвекция Б) теплопроводность В) излучение
11.
Внутренняя энергия обозначается
A) Q
В) A
С) U
12.
Почему грязный снег в солнечную погоду тает быстрее, чем чистый?
А.
Грязный снег поглощает солнечные лучи в большей степени.
Б.
Чистый снег отражает солнечные лучи сильнее, чем грязный.
В.
Оба ответа верны
Содержание:
Термодинамические системы и макропараметры состояния вещества:
Термодинамический подход основывается на понятии термодинамической системы, которая представляет собой любое макроскопическое тело или совокупность таких тел. Состояние термодинамической системы определяется ее внутренними параметрами, например состоянием движения микрочастиц, из которых состоит тело. Тепловое состояние тела, которое характеризуется температурой, тесно связано со скоростью движения атомов и молекул — чем больше скорость их движения, тем выше температура тела.
Температура тела зависит от скорости движения атомов и молекул, из которых оно состоит, — чем больше скорость, тем выше температура.
Внутреннее состояние тела очень сложно определить через параметры движения микрочастиц, потому что их очень много. Поэтому, чтоб упростить описание состояния термодинамической системы, его связывают с физическими величинами, которые характеризуют тело в целом, независимо от его молекулярного строения. К таким величинам принадлежат, в частности, масса, объем, плотность, давление, температура и т. п.
Их называют макропараметрами системы. Фактически они являются усредненными значениями данных физических величин на протяжении длительного времени.
Температура — один из основных макропараметров термодинамической системы, характеризующий состояние ее теплового или термодинамического равновесия. Сущность данного понятия объясняется течением тепловых явлений и процессов.
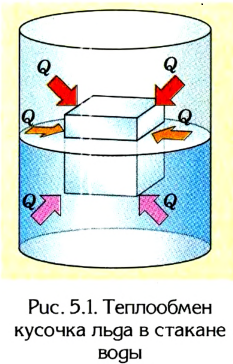
Например, из собственного опыта нам известно, что более нагретые тела отдают теплоту менее нагретым, вследствие чего со временем их температуры станут одинаковыми. Если, к примеру, кусочек льда бросить в стакан с теплой водой (рис. 5.1), то лед будет таять, а вода в стакане охлаждаться, отдавая определенное количество теплоты тающему льду. Кроме того, стакан с водой и лед пребывают в состоянии теплообмена с окружающей средой. Поэтому со временем температуры всех этих тел станут одинаковыми.
Тела с более высокой температурой отдают тепловую энергию телам с более низкой температурой; теплообмен происходит до тех пор, пока их температуры не станут одинаковыми.
Следовательно, со временем вследствие теплообмена в термодинамических системах наступает состояние термодинамического равновесия, когда температуры всех тел становятся одинаковыми и теплообмен между ними прекращается. Значение температуры характеризует вполне определенное состояние теплового равновесия термодинамической системы, в котором она пребывает в данный момент. Он может быть изменен в результате термодинамического процесса.
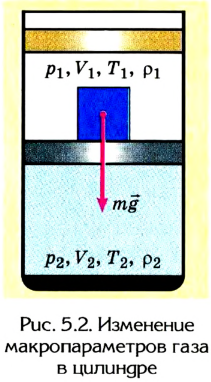
Если, например, на поршень в цилиндре с газом положить груз (рис. 5.2), то объем газа будет изменяться до тех пор, пока давление не сравняется с внешним давлением. Т. е. термодинамическая система «цилиндр — газ» перейдет в иное состояние, характеризующееся новыми значениями макропараметров — давлением 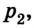
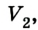
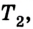
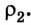
Термодинамика рассматривает в основном состояния термодинамического равновесия и процессы, которые происходят достаточно медленно, и поэтому каждое новое их состояние можно считать равновесным. В состоянии термодинамического равновесия между макропараметрами системы существуют определенные функциональные зависимости, отображаемые уравнениями состояния термодинамической системы.
Карта основ термодинамики:
Термодинамическая система
Раздел физики, изучающий тепловые явления в макроскопических системах, называется термодинамикой. В основе термодинамики лежат термодинамические законы, опирающиеся на большое количество экспериментальных фактов. Эти законы отвечают на вопрос «как?», например, как изменяется состояние тела (твердого тела, жидкости или газа) при нагревании (или охлаждении), в каком направлении и как передается тепло, как изменяется температура газа при его расширении и другие. Объектами исследования термодинамики являются термодинамические системы.
Любое макроскопическое тело или система макроскопических тел называется термодинамической системой. Состояние термодинамической системы характеризуется макроскопическими или термодинамическими параметрами (масса, плотность, объем, давление, температура).
Внутренняя энергия
Величины, определяющие состояние термодинамической системы в данный момент времени, то есть соответствующие этому состоянию макроскопические параметры, называются функциями состояния. Основной среди этих величин является внутренняя энергия.
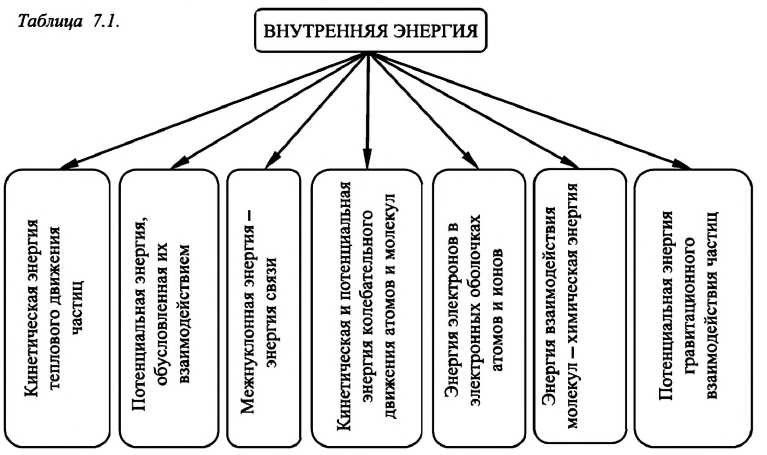
Внутренняя энергия — это сумма кинетических энергий различных видов, движения частиц системы и потенциальных энергий взаимодействия этих частиц (см.: таблица 7.1).
Внутренняя энергия термодинамической системы является функцией температуры и объема, определяющих состояние системы:
Внутренняя энергия одноатомного идеального газа
Газ, молекулы которого состоят из одного атома, называют одноатомным газом. Внутренняя энергия одноатомного газа равна сумме кинетических энергий поступательного движения частиц и потенциальных энергий их взаимодействия:
Однако внутренняя энергия идеального газа данной массы равна сумме средних кинетических энергий хаотического движения частиц:
Средняя кинетическая энергия одной частицы одноатомного идеального газа определяется выражением 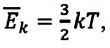
Это выражение является формулой закона Джоуля:
Внутренняя энергия идеального газа зависит от ее массы, рода (молярной массы) и температуры. Даже если давление и объем газа изменятся, при постоянной температуре его внутренняя энергия не изменится.
Сопоставив формулу (7.1) с выражением Менделеева-Клапейрона, получим:
Способы изменения внутренней энергии
Для изменения внутренней энергии термодинамической системы необходимо изменить или среднюю кинетическую энергию теплового движения молекул системы, или потенциальную энергию их взаимодействия, или же изменить обе энергии одновременно. Из многочисленных опытов было определено, что существует два способа изменения внутренней энергии: теплопередача и совершение работы.
Изменение внутренней энергии системы происходит двумя способами: передачей количества теплоты 
Если внутренняя энергия изменяется только в результате теплообмена, то изменение внутренней энергии равно полученному (или отданному) системой количеству теплоты. Например, при нагревании и охлаждении тела изменение его внутренней энергии определяется так:
Изменение внутренней энергии в процессе плавления твердого тела или кристаллизации жидкости происходит за счет изменения потенциальной энергии взаимодействия молекул тела. Изменение внутренней энергии при этих процессах численно равно теплоте плавления (кристаллизации):
Где 
Изменение внутренней энергии тела в процессе парообразования и конденсации также равно затраченному во время этого процесса количеству теплоты:
Где 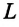
Изменение внутренней энергии одноатомного идеального газа определяется изменением его температуры:
Где 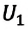
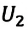
Внимание. Изменение внутренней энергии термодинамической системы зависит не от вида процесса, а от его начального и конечного состояния.
Работа в термодинамике
Если изменение внутренней энергии происходит только в результате совершения механической работы, то это изменение равно или работе внешних сил над системой 
Работа в термодинамике — это одна из мер изменения внутренней энергии термодинамической системы.
Работа газа
Предположим, что в толстостенном цилиндре находится газ, сжимаемый поршнем. При сжатии поршень передает часть своей кинетической энергии молекулам газа, в результате чего увеличивается внутренняя энергия газа и повышается его температура — внешние силы совершают работу над газом. При расширении, наоборот, молекулы газа, передавая часть своей кинетической энергии поршню, уменьшают свою скорость и газ охлаждается — он совершает работу над внешними силами (b).
Таким образом, работа, совершенная газом над внешними силами, в результате расширении газа данной массы при постоянном давлении равна:
или
Работа же, совершенная внешними силами над газом равна :
Где 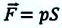
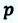
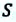

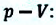
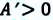
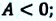
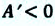
Если в процессе совершения работы газ через некоторое время возвращается в первоначальное состояние, то такой процесс называется замкнутым или циклическим процессом.
Если стрелки, показывающие направление циклического процесса, совпадают с направлением вращения часовых стрелок, то работа газа положительна, а работа внешних сил отрицательна (d). Если же стрелки, определяющие направление процесса, направлены против вращения часовых стрелок, то работа газа отрицательна, а работа внешних сил положительна.
Что такое термодинамическая система
Полную энергию физической системы можно представить как алгебраическую сумму её механической энергии и внутренних энергий тел, образующих систему. Убыль механической энергии системы в ряде случаев происходит при самопроизвольном переходе её части во внутреннюю энергию тел системы. Так, например, режущие инструменты заметно нагреваются при заточке. При скольжении конькобежца под коньками тает лёд, что обеспечивает хорошее скольжение. В этих примерах тела при трении нагреваются, и интенсивность теплового движения их молекул возрастает, что приводит к увеличению внутренней энергии тел. Как же определить внутреннюю энергию термодинамической системы? И что понимают под термодинамической системой?
В термодинамике физические тела и их модели называют термодинамическими системами. Для их описания используют параметры системы, такие, как давление, объём, температура (макропараметры), а не физические характеристики молекул (микропараметры). Макропараметры можно непосредственно измерить, используя приборы, или выразить через другие величины, которые можно измерить на опыте. Мы рассмотрим простейшие термодинамические системы, состояние которых определяют, используя только давление, объём и температуру.
Тела, образующие термодинамическую систему, могут обмениваться с окружающей средой энергией, а также веществом. Если этого не происходит, то термодинамическую систему называют замкнутой или изолированной.
Что такое внутренняя энергия
Рассматривая полную энергию макроскопического тела, необходимо учитывать не только его механическую энергию (кинетическую и потенциальную), но также и энергию, заключённую внутри самого тела, — внутреннюю энергию.
Внутренняя энергия макроскопического тела — алгебраическая сумма кинетической энергии теплового движения всех частиц, образующих тело, и потенциальной энергии их взаимодействия.
Внутренняя энергия любой термодинамической системы состоит из внутренних энергий тел, входящих в данную систему, и является одной из основных физических величин, используемых в термодинамике.
В термодинамике представляет интерес не само значение внутренней энергии системы, а её изменение. Поэтому обычно принимают во внимание только те составляющие внутренней энергии, которые изменяются в рассматриваемых процессах.
Рассмотрим переход некоторой массы идеального газа из состояния 1, в котором его внутренняя энергия 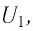
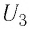
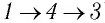
Внутренняя энергия зависит от конкретного состояния системы. Это означает, что изменение внутренней энергии при переходе термодинамической системы из одного состояния в другое зависит только от значений параметров этих состояний и не зависит от процесса перехода.
Внутренняя энергия идеального одноатомного газа
Определим внутреннюю энергию идеального одноатомного газа, т. е. газа, образованного атомами. Например, одноатомными газами являются инертные газы — гелий, неон, аргон и др.
Из определения понятия «идеальный газ» следует, что его внутренняя энергия является суммой кинетических энергий хаотического движения всех атомов (или молекул) (потенциальная энергия взаимодействия между частицами отсутствует). Следовательно, внутренняя энергия идеального одноатомного газа равна произведению средней кинетической энергии 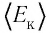
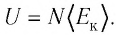
где 
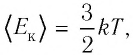
С учётом того, что произведение постоянной Больцмана и постоянной Авогадро 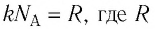
или
Из формулы (11.1) следует, что внутренняя энергия данной массы идеального одноатомного газа пропорциональна его абсолютной температуре. Она не зависит от других макроскопических параметров состояния — давления и объёма. Следовательно, изменение внутренней энергии данной массы одноатомного идеального газа происходит только при изменении его температуры:
При определении внутренней энергии реальных газов, жидкостей и твёрдых тел необходимо учитывать потенциальную энергию взаимодействия частиц, которая зависит от расстояния между ними. Поэтому в общем случае внутренняя энергия макроскопических тел зависит не только от абсолютной температуры, но и от объёма.
Изменить внутреннюю энергию термодинамической системы можно двумя способами: используя теплообмен и совершая работу. Процесс теплообмена и совершение работы характеризуют соответственно физическими величинами — количеством теплоты Q и работой А, которые являются мерами изменения внутренней энергии системы.
Пример решения задачи №1
При изобарном охлаждении внутренняя энергия идеального одноатомного газа изменилась на 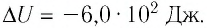
Решение. Приращение внутренней энергии некоторого количества идеального одноатомного газа
Используя уравнение Клапейрона—Менделеева, можно осуществить замену:
Решая совместно уравнения (1) и (2), получим:
Ответ:
Внутренняя энергия тела
Любое макроскопическое тело обладает энергией, что обусловлено его микросостоянием. Эта энергия называется внутренней (обозначается U). Она равна энергии всех микрочастиц вещества, из которых состоит данное тело. Например, внутренняя энергия идеального газа состоит из кинетической энергии всех его молекул, без учета их потенциальной энергии, поскольку взаимодействием молекул в модели идеального газа пренебрегают.
Модель идеального газа предусматривает, что молекулы пребывают на расстоянии нескольких диаметров друг от друга. Поэтому энергия их взаимодействия намного меньше энергии их движения, следовательно, ею можно пренебречь.
В реальных газах, а также в жидкостях и твердых телах внутреннюю энергию необходимо учитывать, потому что она соизмерима с кинетической энергией и существенно влияет на их свойства. В таком случае их внутренняя энергия состоит из кинетической энергии теплового движения микрочастиц и потенциальной энергии их взаимодействия.
Для того чтобы изменить внутреннюю энергию тела, следует фактически изменить или кинетическую энергию теплового движения микрочастиц, или потенциальную энергию их взаимодействия, или и ту и другую вместе. Многовековой опыт человечества убеждает нас в том, что это можно сделать двумя способами — либо в процессе теплообмена, либо в ходе выполнения работы. В первом случае это произойдет вследствие передачи определенного количества теплоты Q; во втором — в результате выполнения работы А.
Изменение внутренней энергии тела может произойти за счет теплообмена или в результате выполнения работы:
Следовательно, передача количества теплоты и выполнение работы являются факторами, благодаря которым можно изменить внутреннюю энергию тела:
В случае, когда происходит лишь теплообмен, полученное или отданное телом количество теплоты полностью идет на изменение его внутренней энергии, в частности кинетической энергии его атомов и молекул: 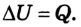
В процессе плавления или кристаллизации твердых тел внутренняя энергия изменяется за счет потенциальной энергии взаимодействия микрочастиц, потому что происходит структурная перестройка вещества. В данном случае изменение внутренней энергии равно теплоте плавления (кристаллизации) тела:
где 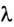
Если изменение внутренней энергии тела происходит вследствие теплообмена, то 
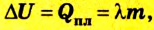
Испарение жидкости или конденсация пара также ведет к изменению внутренней энергии, которая равна в таком случае теплоте парообразования:
где r — удельная теплота парообразования (конденсации) жидкости.
Изменение внутренней энергии тела вследствие выполнения механической работы (без теплообмена) равно значению работы:
Следовательно, с точки зрения молекулярной физики внутренняя энергия тела является суммой кинетической энергии теплового движения атомов, молекул и других частиц, из которых оно состоит, и потенциальной энергии их взаимодействия. Это энергия термодинамической системы, которая зависит от ее внутреннего состояния. Поэтому вычисляют изменение внутренней энергии 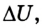
Работа газа
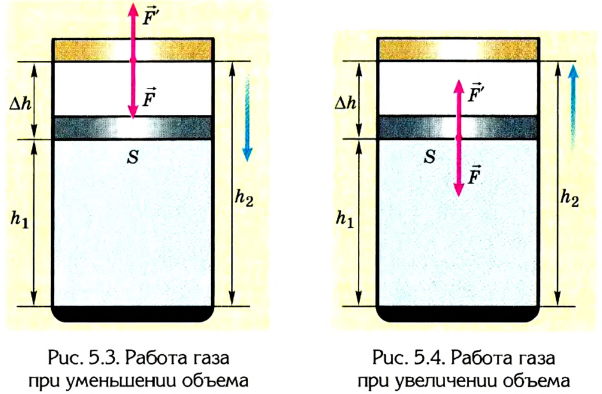
Вычисление выполненной работы в термодинамике связывают с макропараметрами системы. Рассмотрим газ, находящийся в цилиндре под поршнем площадью S (рис. 5.3).
Пусть на газ действует поршень, вызывая его сжатие. Под действием силы F поршень опускается на высоту 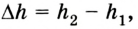
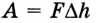
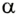
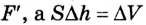
Поскольку 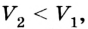
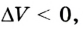
Если под действием силы давления F’ газ расширяется (рис. 5.4), т. е. он сам выполняет работу 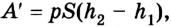
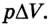
Во время незначительных изменений объема и при постоянном давлении формулы (1) и (2) справедливы не только для газов, но и иных термодинамических систем. Поскольку изменение объема при постоянном давлении сопровождается изменением температуры тела, то можно сделать вывод, что выполнение работы в термодинамике вызывает изменение состояния тела, ведь при этом изменяются его температура Т и объем V.
Первый закон термодинамики
Тот факт, что внутреннюю энергию тела можно изменить двумя способами — в результате выполнения работы или за счет теплопередачи, вынуждал ученых искать соотношение между соответствующими величинами. Вначале в 1842 г. немецкий естествоиспытатель Р. Майер теоретически установил, а затем в 1843 г. английский ученый Дж. Джоуль экспериментально измерил эквивалентность значений количества теплоты и работы. В соответствии с полученными результатами ученые сделали обобщения, которые касались сохранения энергии в природе: энергия в природе не возникает из ничего и не пропадает бесследно; она лишь переходит из одного вида в другой.
Позже этот фундаментальный закон природы приобрел логическую форму первого закона термодинамики: переход термодинамической системы из одного состояния в другое характеризуется изменением ее внутренней энергии, равной сумме работы внешних сил и количества теплоты, переданной системе:
В каком бы состоянии не было тело, оно обладает определенной внутренней энергией. Однако нельзя утверждать, что оно содержит определенное количество теплоты либо запас выполненной работы. Независимо от того, каким из этих способов произведено изменение состояния тела, его состояние однозначно определяется внутренней энергией. Например, газ может быть нагрет за счет передачи ему некоторого количества теплоты либо в результате выполнения внешними силами над ним работы (сжатие газа). Однако невозможно однозначно указать, благодаря какому из этих процессов — выполнению работы или теплопередаче — произошло нагревание газа.
Если система сама выполняет работу (А = -А’), то первый закон термодинамики приобретает другой вид:
т. е. передача термодинамической системе определенного количества теплоты вызывает изменение ее внутренней энергии или выполнение работы, либо то и другое одновременно.
Еще в 1775 г. Французская академия наук приняла решение не рассматривать проекты вечных двигателей.
Последняя формулировка первого закона термодинамики важна с точки зрения отрицания возможности создания вечного двигателя: нельзя создать машину, которая бы неограниченно выполняла работу, не получая энергию извне. Ведь, если количество теплоты Q = 0, то А’ = 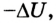
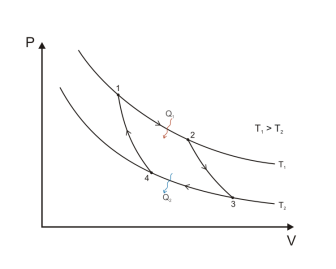
Тепловые двигатели
Человечество научилось использовать тепловую энергию, создав тепловые машины и двигатели. В основу их действия положена идея, что выполнение механической работы может осуществляться за счет теплоты, получаемой от какого-либо нагревателя и частично отдаваемой холодильнику.
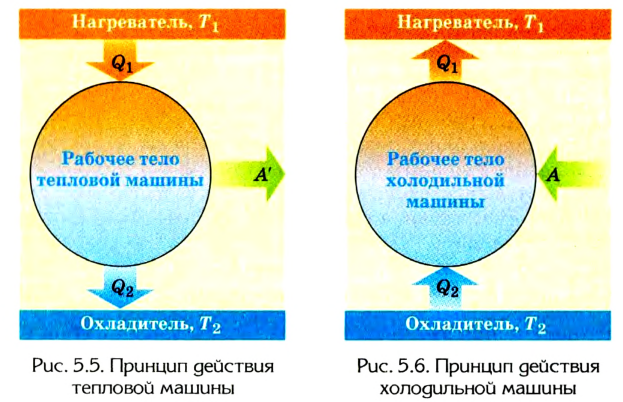
Принцип действия тепловой машины можно представить схематически (рис. 5.5). Нагреватель передает рабочему телу определенное количество теплоты 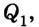
может быть газ или пар, выполняющие работу вследствие своего расширения при нагревании. В паровых турбинах это происходит благодаря паровым котлам, в двигателях внутреннего сгорания — в результате сгорания топливной смеси, в реактивных двигателях — за счет большой теплоотдачи топлива во время быстрого его сгорания.
Выполняя работу, рабочее тело отдает определенную часть количества теплоты 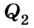
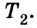
Согласно закону сохранения энергии значение выполненной работы 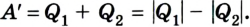
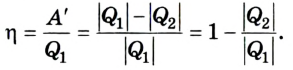
Следовательно, коэффициент полезного действия тепловой машины всегда меньше 1 (часто его представляют в процентах). К примеру, у двигателей внутреннего сгорания он равен приблизительно 44 %, у паровых турбин — до 40 %.
Коэффициент полезного действия равен отношению величины выполненной работы к затраченной при этом энергии:
Холодильник также является тепловой машиной. Принцип его действия основан на обратимости цикла тепловой машины. Холодильная машина работает как тепловой насос: она отбирает тепловую энергию у менее нагретого тела и передает ее более нагретому (рис. 5.6). Это не противоречит законам термодинамики, поскольку охлаждение происходит за счет выполнения работы.
Для того чтобы привести в действие холодильную машину, необходимо над рабочим телом выполнить работу. В таком случае нагревателю будет передаваться количество теплоты, превышающее по значению то, которое отбирается у охладителя: 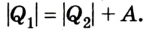
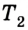
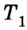
Эффективность работы холодильной машины характеризуется отношением количества теплоты 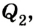
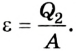
Основные определения и формулы
В основу термодинамического подхода положено описание термодинамической системы при помощи легко измеримых макропараметров — температуры (Т), давления (р), объема (V), массы (m) и др.
Внутренняя энергия тела равна энергии всех микрочастиц вещества, из которых оно состоит. Ее можно изменить за счет теплообмена или в результате выполнения работы. Количество теплоты, переданное телу (либо отобранное у него), определяется в зависимости от теплового процесса, который при этом осуществляется:
при нагревании (охлаждении )
при плавлении (кристаллизации )
при парообразовании (конденсации)
Работа газа при постоянном давлении (р = const) равна: 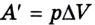
Первый закон термодинамики устанавливает, что количество теплоты, переданное термодинамической системе, вызывает изменение ее внутренней энергии или выполнение работы, либо и той другое одновременно:
Он отражает сущность фундаментального закона сохранения энергии, которым отрицается возможность создания вечного двигателя: нельзя создать машину, которая неограниченно выполняла бы работу, не получая энергию извне.
Законы термодинамики получили широкое практическое применение, в частности, в технике, при конструировании тепловых машин. Все тепловые машины (двигатели внутреннего сгорания, реактивные двигатели, паровые и газовые турбины, холодильные машины и пр.) построены по принципу выполнения механической работы за счет внутренней энергии. Их КПД всегда меньше 1 и равен:
Основы термодинамики
В 9 классе вы узнали, что полная энергия физической системы представляет собой сумму её механической энергии и внутренних энергий тел, образующих систему. Причём изменение механической энергии в ряде случаев происходит в результате перехода её части во внутреннюю энергию тел системы. Режущие инструменты заметно нагреваются при заточке их на точильном камне. При скольжении конькобежца по льду под коньками тает лёд, что обеспечивает хорошее скольжение. В этих примерах тела при трении нагреваются, и интенсивность хаотического движения молекул возрастает, что приводит к увеличению внутренней энергии тел. Как же определить внутреннюю энергию термодинамической системы? И что понимают под термодинамической системой?
Выводы термодинамики основаны на фундаментальных законах, называемых началами термодинамики. Эти законы установлены в результате обобщения многочисленных экспериментальных фактов. Опираясь на них, термодинамика позволяет делать определённые выводы о свойствах исследуемых систем, которые подтверждаются экспериментально. Физические тела и их модели в термодинамике называют термодинамическими системами. Термодинамическую систему характеризуют набором параметров, определяющих её состояние. В отличие от молекулярно-кинетической теории в термодинамике не рассматривают микроскопическое строение тел и для их описания используют не физические характеристики молекул (микропараметры), а параметры системы (макропараметры), такие как давление, объём, температура.
Замкнутая, или же изолированная, термодинамическая система стремится к равновесию, когда все её макропараметры не изменяются с течением времени. Иначе говоря, для каждой изолированной термодинамической системы существует состояние термодинамического равновесия, в которое она переходит самопроизвольно.
Это утверждение называют нулевым началом термодинамики.
Говоря о полной энергии макроскопического тела, необходимо всегда учитывать не только его механическую энергию (кинетическую и потенциальную), но также кинетическую энергию теплового движения его частиц и потенциальную энергию их взаимодействия. В термодинамике под внутренней энергией тела понимают полную энергию, относящуюся к самим частицам, образующим тело. Это кинетическая энергия теплового движения молекул, кинетическая энергия движения атомов внутри молекул, потенциальная энергия взаимодействия между молекулами, энергия электронных оболочек атомов и внутриядерная энергия.
Внутренняя энергия любой термодинамической системы состоит из внутренних энергий тел, входящих в данную систему.
В термодинамике главную роль играет не сама внутренняя энергия, а её изменение, которое происходит при переходе системы из одного состояния в другое. Под приращением (изменением) внутренней энергии понимают разность внутренних энергий в конечном и начальном состояниях:
Например, переход некоторой массы идеального газа из состояния / в состояние 3 (рис. 49) можно осуществить или в ходе процесса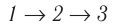
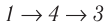
Внутренняя энергия является функцией состояния системы. Это означает, что изменение внутренней энергии при переходе термодинамической системы из одного состояния в другое зависит только лишь от значений параметров этих состояний, а не от процесса перехода.
Внутренняя энергия идеального одноатомного газа:
Определим внутреннюю энергию идеального одноатомного газа, т. е. газа, состоящего из отдельных атомов. Например, к одноатомным газам относят инертные газы — гелий, неон, аргон и др.
Из определения понятия «идеальный газ» следует, что его внутренняя энергия является суммой кинетических энергий хаотического движения всех молекул или атомов (взаимодействие между частицами отсутствует). Следовательно, внутренняя энергия идеального одноатомного газа равна произведению средней кинетической энергии 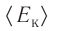
т. е. 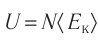
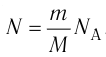
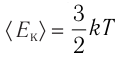
С учётом того, что 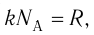
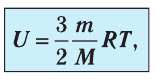
или
Как видно из формулы (9.1), внутренняя энергия данной массы идеального одноатомного газа пропорциональна абсолютной температуре газа. Она не зависит от других макроскопических параметров состояния — давления и объёма. Следовательно, изменение внутренней энергии данной массы идеального одноатомного газа происходит только при изменении его температуры:
При определении внутренней энергии реальных газов, жидкостей и твёрдых тел необходимо учитывать потенциальную энергию взаимодействия частиц, которая зависит от расстояния между ними. Поэтому в общем случае внутренняя энергия макроскопических тел зависит не только от абсолютной температуры, но и от объёма.
При изучении физики в 8 классе вы узнали, что изменить состояние термодинамической системы можно двумя способами: используя теплопередачу и совершая работу. Процесс теплопередачи и совершение работы характеризуют соответственно физическими величинами — количеством теплоты Q и работой А, которые являются мерами изменения внутренней энергии системы.
- Физические тела и их модели в термодинамике называют термодинамическими системами. Термодинамическую систему характеризуют набором макронараметров, определяющих её состояние.
- Состояние изолированной термодинамической системы, когда все её макропараметры не изменяются с течением времени, называют равновесным.
- Под внутренней энергией термодинамической системы понимают сумму кинетической энергии всех частиц системы и потенциальной энергии их взаимодействия.
- Изменение внутренней энергии тела при переходе из одного состояния в другое зависит только лишь от значений параметров этих состояний, а не от процесса перехода.
- Внутренняя энергия данной массы идеального одноатомного газа зависит только от температуры:
Пример решения задачи №2
На рисунке 51 в координатах (р, V) изображён процесс перехода идеального одноатомного газа определённой массы из состояния 1 в состояние 2. Определите приращение внутренней энергии газа, если давление газа в конечном состоянии 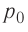
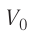
Решение.
Приращение внутренней энергии идеального одноатомного газа 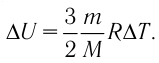
изменение температуры 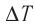
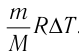
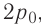
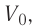
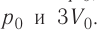
Вычтем из уравнения (2) уравнение (1):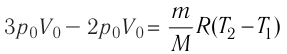
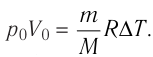
Ответ:
- Необратимость тепловых процессов
- Адиабатический процесс
- Молекулярно-кинетическая теория
- Работа в термодинамике
- Освоение космоса — история, этапы и достижения с фотографиями
- Закон сохранения механической энергии в физике
- Релятивистская механика в физике
- Теория относительности Эйнштейна
Наука о тепловых явлениях называется термодинамика. Термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем.
При изучении основ термодинамики необходимо помнить следующие определения. Физическая система, состоящая из большого числа частиц — атомов или молекул, которые совершают тепловое движение и, взаимодействуя между собой, обмениваются энергиями, называется термодинамической системой.
Состояние термодинамической системы определяется макроскопическими параметрами, например удельным объемом, давлением, температурой.
Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. Важным свойством термодинамически равновесной системы является выравнивание температуры всех ее частей.
Термодинамика рассматривает только равновесные состояния, т.е. состояния, в которых параметры термодинамической системы не меняются со временем.
Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом.
Термодинамическим процессом называется переход системы из начального состояния в конечное через последовательность промежуточных состояний.
Процессы бывают обратимыми и необратимыми.
Обратимым называется такой процесс, при котором возможен обратный переход системы из конечного состояния в начальное через те же промежуточные состояния, чтобы в окружающих телах не произошло никаких изменений. Обратимый процесс является физической абстракцией. Примером процесса, приближающегося к обратимому, является колебание тяжелого маятника на длинном подвесе. В этом случае кинетическая энергия практически полностью превращается в потенциальную, и наоборот. Колебания происходят долго без заметного уменьшения амплитуды ввиду малости сопротивления среды и сил трения.
Любой процесс, сопровождаемый трением или теплопередачей от нагретого тела к холодному, является необратимым. Примером необратимого процесса является расширение газа, даже идеального, в пустоту. Расширяясь, газ не преодолевает сопротивления среды, не совершает работы, но, для того чтобы вновь собрать все молекулы газа в прежний объем, т. е. привести газ в начальное состояние, необходимо затратить работу. Таким образом, все реальные процессы являются необратимыми.
Изменение внутренней энергии газа в процессе теплообмена и совершаемой работы.
Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом.
Внутренняя энергия – это сумма энергий молекулярных взаимодействий и энергии теплового движения молекул.
В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема (закон Джоуля).
Молекулярно-кинетическая теория приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др.), молекулы которого совершают только поступательное движение:
Поскольку потенциальная энергия взаимодействия молекул зависит от расстояния между ними, в общем случае внутренняя энергия
U тела зависит наряду с температурой T также и от объема V: U = U(T, V).
Таким образом, внутренняя энергия системы зависит только от её состояния и является однозначной функцией состояния, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние.
Внутреннюю энергию тела можно изменить разными способами:
- Совершение механической работы.
- Теплообмен.
Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную).
Например, газ подвергается сжатию в цилиндре под поршнем площадью S. Поршень, сжимая газ, движется с некоторой скоростью v. Молекулы газа, беспорядочно двигаясь, ударяются о поршень. После упругого удара молекулы о поршень скорость молекулы возрастает, а значит возрастает и её кинетическая энергия, что приводит к увеличению внутренней энергии газа.
При сжатии газа его внутренняя энергия увеличивается за счет совершения поршнем механической работы. При расширении газа его внутренняя энергия уменьшается, превращаясь в механическую энергию поршня.
При сжатии газа внешние силы совершают над газом некоторую положительную работу A’.
В то же время силы давления, действующие со стороны газа на поршень, совершают работу
A = –A’.
Если объем газа изменился на малую величину ΔV, то газ совершает работу pSΔx = pΔV, где p – давление газа, S – площадь поршня, Δx – его перемещение.
При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна.
В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой:
или в пределе при ΔVi → 0: 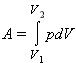
Работа численно равна площади под графиком процесса на диаграмме (p, V):
Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное. На рис. 2 изображены три различных процесса, переводящих газ из состояния (1) в состояние (2). Во всех трех случаях газ совершает различную работу.
Рисунок 2.
Три различных пути перехода из состояния (1) в состояние (2).
Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса.
Процессы, изображенные на рис. 2, можно провести и в обратном направлении; тогда работа A просто изменит знак на противоположный.
Процессы которые можно проводить в обоих направлениях, называются обратимыми.
В отличие от газа, жидкости и твердые тела мало изменяют свой объем, так что во многих случаях работой, совершаемой при расширении или сжатии, можно пренебречь. Однако, внутренняя энергия жидких и твердых тел также может изменяться в результате совершения работы. При механической обработке деталей (например, при сверлении) они нагреваются. Это означает, что изменяется их внутренняя энергия.
Внутренняя энергия тела может изменяться не только в результате совершаемой работы, но и вследствие теплообмена.
При тепловом контакте тел внутренняя энергия одного из них может увеличиваться, а внутренняя энергия другого – уменьшаться. В этом случае говорят о тепловом потоке от одного тела к другому. Передача энергии от одного тела другому в форме тепла может происходить только при наличии разности температур между ними.
Приведем в соприкосновение два тела с разными температурами. Пусть температура первого тела выше, чем второго. В результате обмена энергиями температура первого тела уменьшается, а второго — увеличивается. В рассматриваемом примере кинетическая энергия хаотического движения молекул первого тела переходит в кинетическую энергию хаотического движения молекул второго тела.
Тепловой поток всегда направлен от горячего тела к холодному.
Процесс передачи внутренней энергии без совершения механической работы называется теплообменом.
Мерой энергии, получаемой или отдаваемой телом в процессе теплообмена, служит физическая величина, называемая количеством теплоты.
Количеством теплоты Q, полученной телом, называют изменение внутренней энергии тела в результате теплообмена.
Количество теплоты Q является энергетической величиной. В СИ количество теплоты измеряется в единицах механической работы – джоулях (Дж).
До введения СИ количество теплоты выражали в калориях.
Калория — это количество теплоты, необходимое для нагревания 1 г дистиллированной воды на 1°С, от 19,5°С до 20,5°С.
Единица, в 1000 раз большая калории, называется килокалорией (1 ккал = 1000 кал). Соотношение между единицами: 1 кал =4,19 Дж.
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются.
Чтобы нагреть тело массой m от температуры t1 до температуры t2 ему необходимо сообщить количество теплоты
Q = cm(t2 – t1)
Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c.
c = Q / (mΔT).
Во многих случаях удобно использовать молярную теплоемкость C:
C = M · c, где M – молярная масса вещества.
При передаче тепла от одного тела к другому всегда выполняется уравнение теплового баланса, по которому количество теплоты Q1, отданное первым телом, равно количеству теплоты Q2, полученному вторым телом.
Q1 = Q2
Теплота и работа являются не видом энергии, а формой ее передачи, они существуют лишь в процессе передачи энергии.
В реальных условиях оба способа передачи энергии системе в форме работы и форме теплоты обычно сопутствуют друг другу.
Первое начало термодинамики.
На рисунке изображены энергетические потоки между термодинамической системой и окружающими телами. в результате теплообмена и совершаемой работы:
Величина Q > 0, если тепловой поток нправлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную работу над окружающими телами.
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, то есть изменяются ее макроскопические параметры (температура, давление, объем).
Процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
ΔU = Q – A.
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Q = ΔU + A.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Если между телами, составляющими замкнутую систему, действуют силы трения, то часть механической энергии превращается во внутреннюю энергию тел (нагревание).
При любых физических взаимодействиях энергия не возникает и не исчезает. Она лишь превращается из одной формы в другую. Этот экспериментально установленный факт выражает фундаментальный закон природы – закон сохранения и превращения энергии.
Задачи для самостоятельного решения ( Дмитриева В.Ф. Задачи по физике)
№ 2, стр. 148
Определите p — давление насыщенного водяного пара при температуре Т=290 К, если пло ность насыщенного водяного пара при этой температуре ρ=2,56·10-2 кг/м3 (ответ р=3,43 Па)
№ 12, стр. 149
Определите m — массу стоградусного водяного пара, необходимого для нагревания m1=10 кг воды от t1=100С до t2=600С. (ответ m=0,086 кг)
№ 1, стр. 156
Поверхностное натяжение керосина α=2,4·10-2 Н/м. Какую работу А совершат силы поверхностного натяжения при уменьшении поверхностного слоя керосина на 25 см2? (ответ А=60 мкДж)
№ 7, стр. 156
В одной и той же капиллярной трубке вода поднимается на 50 мм, а спирт на 19 мм. Определите поверхностное натяжение спирта αс. Поверхностное натяжение воды αв=0,072 Н/м (ответ αс=22·10-3 Н/м)
№ 8, стр. 163
Определите Q — теплоту, необходимую для плавления свинца массой m=10 кг, находящегос при температуре плавления. Удельная теплота плавления свинца λ=25 кДж/кг. (ответ Q=250 кДж)
Числом степеней свободы механической системы называют количество независимых величин, с помощью которых может быть задано положение системы.
Внутренняя энергия идеального газа представляет собой сумму только кинетической энергии всех молекул, а потенциальной энергией взаимодействия можно пренебречь:
U=∑Ek0=NEk0=mNAM·ikT2=i2·mMRT=i2νRT=i2pV
i — степень свободы. i = 3 для одноатомного (или идеального) газа, i = 5 для двухатомного газа, i = 6 для трехатомного газа и больше.
Изменение внутренней энергии идеального газа в изопроцессах
| Основная формула |
ΔU=32·mMRT=32νRT=32νR(T2−T1) |
| Изотермический процесс |
ΔU=0 Температура при изотермическом процессе — величина постоянная. Так как внутренняя энергия идеального газа постоянной массы в замкнутой системе зависит только от изменения температуры, то она тоже остается постоянной. |
| Изобарное расширение |
ΔU=32νR(T2−T1)=32(pV2−pV1)=32pΔV |
| Изохорное увеличение давления |
ΔU=32νR(T2−T1)=32(p2V−p1V)=32VΔp |
| Произвольный процесс |
ΔU=32νR(T2−T1)=32(p2V2−p1V1) |
Пример №1. На рисунке показан график циклического процесса, проведенного с идеальным газом. На каком из участков внутренняя энергия газа уменьшалась?
Внутренняя энергия газа меняется только при изменении температуры. Так как она прямо пропорциональная температуре, то уменьшается она тогда, когда уменьшается и температура. Температура падает на участке 3.
Работа идеального газа
Если газ, находящийся под поршнем, нагреть, то, расширяясь, он поднимет поршень, т.е. совершит механическую работу.
Механическая работа вычисляется по формуле:
A=Fscosα
Перемещение равно разности высот поршня в конечном и начальном положении:
s=h2−h1
Также известно, что сила равна произведению давления на площадь, на которое это давление оказывается. Учтем, что направление силы и перемещения совпадают. Поэтому косинус будет равен единице. Отсюда работа идеального газа равна произведению давления на площадь поршня:
Работа идеального газа
F=pS
p — давление газа, S — площадь поршня
Работа, необходимая для поднятия поршня — полезная работа. Она всегда меньше затраченной работы, которая определяется изменением внутренней энергии идеального газа при изобарном расширении:
A‘=p(V2−V1)=pΔV>0
Внимание! Знак работы определяется только знаком косинуса угла между направлением силы, действующей на поршень, и перемещением этого поршня.
Работа идеального газа при изобарном сжатии:
A‘=p(V2−V1)=pΔV<0
Работа идеального газа при нагревании газа:
A‘=νRΔT=νR(T2−T1)=mMνRΔT
Внимание! В изохорном процессе работа, совершаемая газом, равна нулю, так как работа газа определяется изменением его объема. Если изменения нет, работы тоже нет.
Геометрический смысл работы в термодинамике
В термодинамике для нахождения работы можно вычислить площадь фигуры под графиком в осях (p, V).
Примеры графических задач
| Изобарное расширение:
A‘=p(V2−V1) A‘>0 |
 |
| Изобарное сжатие:
A‘=p(V2−V1) A‘<0 |
 |
| Изохорное охлаждение:
V=const A‘=0 |
 |
|
Изохорное охлаждение и изобарное сжатие: 1–2: A‘=0 2–3: A‘=pΔV<0 |
 |
| Замкнутый цикл:
1–2: A‘>0 2–3: A‘=0 3–4: A‘<0 4–1: A‘=0 A‘=(p1−p3)(V2−V1) |
 |
| Произвольный процесс:
A‘=p1+p22(V2−V1) |
 |
Пример №2. На pV-диаграмме показаны два процесса, проведенные с одним и тем же количеством газообразного неона. Определите отношение работ A2 к A1 в этих процессах.
Неон — идеальный газ. Поэтому мы можем применять формулы, применяемые для нахождения работы идеального газа. Работа равна площади фигуры под графиком. С учетом того, что в обоих случаях изобарное расширение, получим:
A2=p(V2−V1)=4p(5V−3V)=4p2V=8pV
A1=p(V2−V1)=p(5V−V)=4pV
Видно, что работа, совершенная во втором процессе, вдвое больше работы, совершенной газом в первом процессе.
Задание EF17505

Для каждой величины подберите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
- Определить по графику, как меняется давление.
- Определить, как меняется объем.
- Определить, отчего зависит внутренняя энергия газа, и как она меняется в данном процессе.
Решение
На графике идеальный одноатомный газ изотермически сжимают, так как температура остается неизменной, а давление увеличивается. При этом объем должен уменьшаться. Но внутренняя энергия идеального газа определяется его температурой. Так как температура постоянна, внутренняя энергия не изменяется.
Ответ: 123
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17758
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105 Па.
• Конечное давление: p2 = 105 Па.
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32νRT
Внутренняя энергия аргона до расширения и после него:
U1=32νRT1
U2=32νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
T=constV
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1=p2V2T2
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2=p2T1p1T2
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2=p2T12p1T2
Отсюда:
T2=T1√p2p1
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32νRT1√p2p1
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32νRT1−32νRT1√p2p1=32νRT1(1−√p2p1)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32νRT1(1−√p2p1)−A
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17966
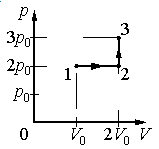
Ответ:
а) р0V0
б) 2р0V0
в) 4р0V0
г) 6р0V0
Алгоритм решения
1.Определить, на каком участке графика совершается работа.
2.Записать геометрический смысл работы.
3.Извлекая данные из графика, вычислить работу, совершенную газом.
Решение
Работа совершается только тогда, когда газ меняет объем. Поэтому работа совершается только на участке 1–2.
Работа идеального газа равна площади фигуры, заключенной под графиком термодинамического процесса в координатах (p, V).
Давление газа при этом равно 2p0, а объем равен разности 2V0 и V0. Следовательно, работа, совершенная газом, будет равна произведению:
A=2p0(2V0−V0)=2p0V0
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор | оценить
Алиса Никитина | Просмотров: 13.2k
Внутренняя энергия
-
Темы кодификатора ЕГЭ: внутренняя энергия, теплопередача, виды теплопередачи.
-
Внутренняя энергия одноатомного идеального газа
-
Функция состояния
-
Изменение внутренней энергии: совершение работы
-
Изменение внутренней энергии: теплопередача
-
Теплопроводность
-
Конвекция
-
Тепловое излучение
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: внутренняя энергия, теплопередача, виды теплопередачи.
Частицы любого тела — атомы или молекулы — совершают хаотическое непрекращающееся движение (так называемое тепловое движение). Поэтому каждая частица обладает некоторой кинетической энергией.
Кроме того, частицы вещества взаимодействуют друг с другом силами электрического притяжения и отталкивания, а также посредством ядерных сил. Стало быть, вся система частиц данного тела обладает ещё и потенциальной энергией.
Кинетическая энергия теплового движения частиц и потенциальная энергия их взаимодействия вместе образуют новый вид энергии, не сводящийся к механической энергии тела (т.е. кинетической энергии движения тела как целого и потенциальной энергии его взаимодействия с другими телами). Этот вид энергии называется внутренней энергией.
Внутренняя энергия тела — это суммарная кинетическая энергия теплового движения его частиц плюс потенциальная энергия их взаимодействия друг с другом.
Внутренняя энергия термодинамической системы — это сумма внутренних энергий тел, входящих в систему.
Таким образом, внутреннюю энергию тела образуют следующие слагаемые.
1. Кинетическая энергия непрерывного хаотического движения частиц тела.
2. Потенциальная энергия молекул (атомов), обусловленная силами межмолекулярного взаимодействия.
3. Энергия электронов в атомах.
4. Внутриядерная энергия.
В случае простейшей модели вещества — идеального газа — для внутренней энергии можно получить явную формулу.
к оглавлению ▴
Внутренняя энергия одноатомного идеального газа
Потенциальная энергия взаимодействия частиц идеального газа равна нулю (напомним, что в модели идеального газа мы пренебрегаем взаимодействием частиц на расстоянии). Поэтому внутренняя энергия одноатомного идеального газа сводится к суммарной кинетической энергии поступательного (у многоатомного газа приходится ещё учитывать вращение молекул и колебания атомов внутри молекул) движения его атомов. Эту энергию можно найти, умножив число атомов газа на среднюю кинетическую энергию
одного атома:
или
Мы видим, что внутренняя энергия идеального газа (масса и химический состав которого неизменнны) является функцией только его температуры. У реального газа, жидкости или твёрдого тела внутренняя энергия будет зависеть ещё и от объёма — ведь при изменении объёма изменяется взаимное расположение частиц и, как следствие, потенциальная энергия их взаимодействия.
к оглавлению ▴
Функция состояния
Важнейшее свойство внутренней энергии заключается в том, что она является функцией состояния термодинамической системы. А именно, внутренняя энергия однозначно определяется набором макроскопических параметров, характеризующих систему, и не зависит от «предыстории» системы, т.е. от того, в каком состоянии система находилась прежде и каким конкретно образом она оказалась в данном состоянии.
Так, при переходе системы из одного состояния в другое изменение её внутренней энергии определяется лишь начальным и конечным состояниями системы и не зависит от пути перехода из начального состояния в конечное. Если система возвращается в исходное состояние, то изменение её внутренней энергии равно нулю.
Опыт показывает, что существует лишь два способа изменения внутренней энергии тела:
• совершение механической работы;
• теплопередача.
Попросту говоря, нагреть чайник можно только двумя принципиально разными способами: тереть его чем-нибудь или поставить на огонь 
к оглавлению ▴
Изменение внутренней энергии: совершение работы
Если работа совершается над телом, то внутренняя энергия тела возрастает.
Например, гвоздь после удара по нему молотком нагревается и немного деформируется. Но температура — это мера средней кинетической энергии частиц тела. Нагревание гвоздя свидетельствует об увеличении кинетической энергии его частиц: в самом деле, частицы разгоняются от удара молотком и от трения гвоздя о доску.
Деформация же есть не что иное, как смещение частиц друг относительно друга; гвоздь после удара испытывает деформацию сжатия, его частицы сближаются, между ними возрастают силы отталкивания, и это приводит к увеличению потенциальной энергии частиц гвоздя.
Итак, внутренняя энергия гвоздя увеличилась. Это явилось результатом совершения над ним работы — работу совершили молоток и сила трения о доску.
Если же работа совершается самим телом, то внутренняя энергия тела уменьшается.
Пусть, например, сжатый воздух в теплоизолированном сосуде под поршнем расширяется и поднимает некий груз, совершая тем самым работу (процесс в теплоизолированном сосуде называется адиабатным. Мы изучим адиабатный процесс при рассмотрении первого закона термодинамики). В ходе такого процесса воздух будет охлаждаться — его молекулы, ударяя вдогонку по движущемуся поршню, отдают ему часть своей кинетической энергии. (Точно так же футболист, останавливая ногой быстро летящий мяч, делает ею движение от мяча и гасит его скорость.) Стало быть, внутренняя энергия воздуха уменьшается.
Воздух, таким образом, совершает работу за счёт своей внутренней энергии: поскольку сосуд теплоизолирован, нет притока энергии к воздуху от каких-либо внешних источников, и черпать энергию для совершения работы воздух может только из собственных запасов.
к оглавлению ▴
Изменение внутренней энергии: теплопередача
Теплопередача — это процесс перехода внутренней энергии от более горячего тела к более холодному, не связанный с совершением механической работы. Теплопередача может осуществляться либо при непосредственном контакте тел, либо через промежуточную среду (и даже через вакуум). Теплопередача называется ещё теплообменом.
Различают три вида теплопередачи: теплопроводность, конвекция и тепловое излучение.
Сейчас мы рассмотрим их более подробно.
к оглавлению ▴
Теплопроводность
Если железный стержень сунуть одним концом в огонь, то, как мы знаем, долго его в руке не продержишь. Попадая в область высокой температуры, атомы железа начинают колебаться интенсивнее (т.е. приобретают добавочную кинетическую энергию) и наносят более сильные удары по своим соседям.
Кинетическая энергия соседних атомов также возрастает, и теперь уже эти атомы сообщают дополнительную кинетическую энергию своим соседям. Так от участка к участку тепло постепенно распространяется по стержню — от помещённого в огонь конца до нашей руки. Это и есть теплопроводность (рис. 1)(Изображение с сайта educationalelectronicsusa.com).
Рис. 1. Теплопроводность
Теплопроводность — это перенос внутренней энергии от более нагретых участков тела к менее нагретым за счёт теплового движения и взаимодействия частиц тела.
Теплопроводность разных веществ различна. Высокую теплопроводность имеют металлы: лучшими проводниками тепла являются серебро, медь и золото. Теплопроводность жидкостей гораздо меньше. Газы проводят тепло настолько плохо, что относятся уже к теплоизоляторам: молекулы газов из-за больших расстояний между ними слабо взаимодействуют друг с другом. Вот почему, например, в окнах делают двойные рамы: прослойка воздуха препятствует уходу тепла).
Плохими проводниками тепла являются поэтому пористые тела — такие, как кирпич, вата или мех. Они содержат в своих порах воздух. Недаром кирпичные дома считаются самыми тёплыми, а в мороз люди надевают меховые шубы и куртки с прослойкой пуха или синтепона.
Но если воздух так плохо проводит тепло, то почему тогда прогревается от батареи комната?
Происходит это вследствие другого вида теплопередачи — конвекции.
к оглавлению ▴
Конвекция
Конвекция — это перенос внутренней энергии в жидкостях или газах в результате циркуляции потоков и перемешивания вещества.
Воздух вблизи батареи нагревается и расширяется. Действующая на этот воздух сила тяжести остаётся прежней, а выталкивающая сила со стороны окружающего воздуха увеличивается, так что нагретый воздух начинает всплывать к потолку. На его место приходит холодный воздух (тот же процесс, но в куда более грандиозных масштабах, постоянно происходит в природе: именно так возникает ветер), с которым повторяется то же самое.
В результате устанавливается циркуляция воздуха, которая и служит примером конвекции — распространение тепла в комнате осуществляется воздушными потоками.
Совершенно аналогичный процесс можно наблюдать и в жидкости. Когда вы ставите на плиту чайник или кастрюлю с водой, нагревание воды происходит в первую очередь благодаря конвекции (вклад теплопроводности воды тут весьма незначителен).
Конвекционные потоки в воздухе и жидкости показаны на рис. 2 (изображения с сайта physics.arizona.edu).
Рис. 2. Конвекция
В твёрдых телах конвекция отсутствует: силы взаимодействия частиц велики, частицы колеблются вблизи фиксированных пространственных точек (узлов кристаллической решётки), и никакие потоки вещества в таких условиях образоваться не могут.
Для циркуляции конвекционных потоков при отоплении комнаты необходимо, чтобы нагретому воздуху было куда всплывать. Если радиатор установить под потолком, то никакая циркуляция не возникнет — тёплый воздух так под потолком и останется. Именно поэтому нагревательные приборы помещают внизу комнаты. По той же причине чайник ставят на огонь, в результате чего нагретые слои воды, поднимаясь, уступают место более холодным.
Наоборот, кондиционер нужно располагать как можно выше: тогда охлаждённый воздух начнёт опускаться, и на его место будет приходить более тёплый. Циркуляция пойдёт в обратном направлении по сравнению с движением потоков при обогреве комнаты.
к оглавлению ▴
Тепловое излучение
Каким образом Земля получает энергию от Солнца? Теплопроводность и конвекция исключены: нас разделяет 150 миллионов километров безвоздушного пространства.
Здесь работает третий вид теплопередачи — тепловое излучение. Излучение может распространяться как в веществе, так и в вакууме. Как же оно возникает?
Оказывается, электрическое и магнитное поля тесно связаны друг с другом и обладают одним замечательным свойством. Если электрическое поле изменяется со временем, то оно порождает магнитное поле, которое, вообще говоря, также изменяется со временем (подробнее об этом будет рассказано в листке про электромагнитную индукцию). В свою очередь переменное магнитное поле порождает переменное электрическое поле, которое опять порождает переменное магнитное поле, которое опять порождает переменное электрическое поле…
В результате развития этого процесса в пространстве распространяется электромагнитная волна —«зацепленные» друг за друга электрическое и магнитное поля. Как и звук, электромагнитные волны обладают скоростью распространения и частотой — в данном случае это частота, с которой колеблются в волне величины и направления полей. Видимый свет — частный случай электромагнитных волн.
Скорость распространения электромагнитных волн в вакууме огромна: км/с. Так, от Земли до Луны свет идёт чуть больше секунды.
Частотный диапазон электромагнитных волн очень широк. Подробнее о шкале электромагнитных волн мы поговорим в соответствующем листке. Здесь отметим лишь, что видимый свет — это крохотный диапазон данной шкалы. Ниже него лежат частоты инфракрасного излучения, выше — частоты ультрафиолетового излучения.
Вспомним теперь, что атомы, будучи в целом электрически нейтральными, содержат положительно заряженные протоны и отрицательно заряженные электроны. Эти заряженные частицы, совершая вместе с атомами хаотическое движение, создают переменные электрические поля и тем самым излучают электромагнитные волны. Эти волны и называются тепловым излучением — в напоминание о том, что их источником служит тепловое движение частиц вещества.
Источником теплового излучения является любое тело. При этом излучение уносит часть его внутренней энергии. Встретившись с атомами другого тела, излучение разгоняет их своим колеблющимся электрическим полем, и внутренняя энергия этого тела увеличивается. Именно так мы и греемся в солнечных лучах.
При обычных температурах частоты теплового излучения лежат в инфракрасном диапазоне, так что глаз его не воспринимает (мы не видим, как мы «светимся»). При нагревании тела его атомы начинают излучать волны более высоких частот. Железный гвоздь можно раскалить докрасна — довести до такой температуры, что его тепловое излучение выйдет в нижнюю (красную) часть видимого диапазона. А Солнце кажется нам жёлто-белым: температура на поверхности Солнца настолько высока , что в спектре его излучения присутствуют все частоты видимого света, да ещё ультрафиолет, благодаря которому мы загораем.
Давайте ещё раз взглянем на три вида теплопередачи (рис. 3)(изображения с сайта beodom.com).
Рис. 3. Три вида теплопередачи: теплопроводность, конвекция и излучение
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Внутренняя энергия» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
07.02.2023
Физика, 10 класс
Урок 23. Внутренняя энергия. Работа. Количество теплоты
Список вопросов, рассмотренных в уроке: внутренняя энергия; способы изменения внутренней энергии; различные виды теплообмена; уравнение теплового баланса; работа в термодинамике; нахождение численного значения работы в различных тепловых процессах.
Глоссарий по теме
Термодинамическая система представляет собой систему тел, которые взаимодействуют и обмениваются энергией и веществом.
Состояние равновесия — это состояние системы, в которой нет теплообмена между телами, составляющими систему.
Термодинамический процесс — процесс изменения состояния системы, который изменяет параметры системы.
Внутренняя энергия представляет собой сумму кинетической энергии хаотичного теплового движения и потенциальной энергии взаимодействия всех молекул, составляющих тело.
Теплоемкость представляет собой энергию, которая численно равна количеству тепла, которое выделяется или поглощается, когда температура тела изменяется на 1 К.
Теплопередача- это передача энергии от одного тела другому без выполнения работы.
Количество тепла является количественной мерой изменения внутренней энергии во время теплообмена.
Работа в термодинамике — это взаимодействие системы с внешними объектами, в результате чего изменяются параметры системы.
Список литературы
Г.Я. Мякишев., Б. Буховцев., Н. Н. Соцкий. Физика.10. Учебник для образовательных организаций М .: Просвещение, 2017. — С. 243-254.
Рымкевич А.П. Сборник задач по физике. 10-11 класс М.: Дрофа, 2009.- с.75-84
Основное содержание урока
Внутренняя энергия тела — это полная энергия всех молекул, которые его составляют. Внутренняя энергия идеального газа пропорциональна его температуре.
U = 3/2 · ν · R · T
Чтобы изменить внутреннюю энергию вещества, надо сообщить ему некоторое количество тепла или совершить работу.
Работа в термодинамике равна изменению внутренней энергии системы: A = ΔU.
Работа газа в изобарном процессе равна A = P · ΔV. Если газ расширяется, то А > 0, если газ сжимается, то А < 0.
Кроме того, работа газа может быть определена с использованием графика давления в зависимости от объема.
Работа газа численно равна площади под графиком давления.
Количество теплоты — это энергия, которую система получает или теряет во время теплообмена.
Количество тепла для различных термических процессов определяется по-разному.
При нагревании и охлаждении: Q = c_ ∙ m ∙ ΔT;
Во время плавления и кристаллизации: Q = ℷ ∙ m;
Во время испарения и конденсации; Q = r ∙ m;
При сжигании: Q = q ∙ m.
Для замкнутой и адиабатически изолированной системы тел выполняется уравнение теплового баланса: Q1 + Q2 + … + Qn = 0
Выражение для внутренней энергии одноатомного идеального или разреженного реального газа имеет следующий вид:
U = 3/2 ν ∙ R ∙ T
Для идеального газа из молекул с двумя, тремя или более атомами необходимо учитывать кинетическую энергию вращения молекул (они больше не могут считаться материальными точками), поэтому выражение для их внутренней энергии отличается от U = 3/2 ν ∙ R ∙ T числовым коэффициентом.
Для двухатомного газа (например, O2, CO и т. д.):
U = 5/2 ν ∙ R ∙ T
Для газа с тремя атомами или более (например, O3, CH4):
U = 3ν · R · T
Изменить внутреннюю энергию вещества можно, передав ему некоторое количество тепла или выполнить над ним работу.
Существует три типа теплопередачи:
1) Теплопроводность представляет собой процесс переноса энергии от более теплого тела к менее нагретому телу с прямым контактом или от более нагретых частей тела к менее нагретым, осуществляемый хаотично движущимися частицами тела (атомы, молекулы, электроны , и т.д.). Простым примером является нагревание чашки, в которую выливают горячий чай.
2) Конвекция — это своего рода передача тепла, в которой внутренняя энергия передается снизу вверх струями или потоками жидкости или газа. Пример: нагревание воды в чайнике, который стоит на горячей плите.
3) Лучистый обмен или излучение — это процесс передачи энергии через электромагнитное излучение. Простой пример: солнечный свет.
Механическая работа изменяет механическую энергию тела. Термодинамическая работа изменяет внутреннюю энергию газа.
Если газ расширяется, то работа газа считается положительной. Если он сжат, то отрицательной.
Формула для нахождения работы газа в изобарном процессе имеет следующий вид:
A = p · ΔV
Для изотермического процесса формула принимает следующий вид: A = ν ∙ R ∙ T ∙ ln (V_2 / V_1)
Разбор тренировочных заданий
1. Объём газа, расширяющегося при постоянном давлении 100 кПа, увеличился на 20 литров. Работа, выполняемая газом в этом процессе, — _____.
Варианты ответов:
2000 Дж;
20 000 Дж;
200 Дж;
50 МДж.
Правильный вариант / варианты (или правильные комбинации вариантов): 3) 2000 Дж.
Совет: используйте формулу работы.
2. Чтобы из 5 кг снега, при температуре 0ºС, получить воду при 20ºС, необходимо сжигать в печке с КПД 40% __ кг дров.
Решение: при сгорании дров выделится количество теплоты:

из этого количества на полезную работу пойдёт только:
Для плавления снега необходимо количество теплоты:

для нагревания воды понадобится:
Согласно уравнению теплового баланса:

Отсюда следует:
Подставим числовые значения в формулу:
Ответ: 0,5175 кг.