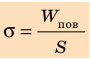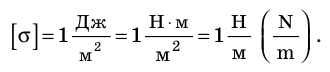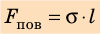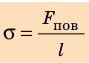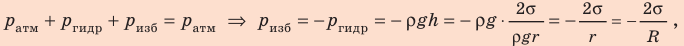Понятие и характеристики поверхностного натяжения
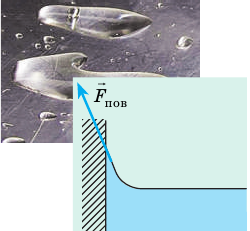
С явлением поверхностного натяжения жидкости мы сталкиваемся каждый день:
- капли воды стремятся принять форму, близкую к шарообразной (а в невесомости они совсем шарообразные);
- струя воды из-под крана стремится к цилиндрической форме;
- булавка не тонет на поверхности воды в стакане;
- многие насекомые могут скользить по поверхности воды.
Силы поверхностного натяжения действуют вдоль поверхности жидкости, стремясь сократить ее площадь. Как будто жидкость заключена в упругую пленку, которая стремится сжать свое содержимое.
Потенциальная энергия взаимного притяжения молекул жидкости примерно равна их кинетической энергии. Это позволяет веществу сохранять объем (но не форму), и этот объем ограничивается поверхностью жидкости.
На молекулу жидкости, которая находится внутри, действуют силы притяжения со стороны других молекул, и они уравновешивают друг друга. А на ту молекулу, что находится на поверхности, действуют силы притяжения не только со стороны других молекул жидкости, но и со стороны газа (внешней среды). Эти вторые значительно меньше первых, поэтому равнодействующая сила притяжения направлена внутрь жидкости, что способствует удержанию молекулы на поверхности.
Поверхностное натяжение — это величина, которая показывает стремление жидкости сократить свою свободную поверхность, то есть уменьшить избыток своей потенциальной энергии на границе раздела с газообразной фазой.
Чем больше площадь поверхности жидкости, тем больше молекул, которые обладают избыточной потенциальной энергией, и тем больше поверхностная энергия. Этот факт можно записать в виде следующего соотношения:
Поверхностная энергия жидкости
W = σS
W — поверхностная энергия жидкости [Дж]
S — площадь свободной поверхности [м2]
σ — коэффициент поверхностного натяжения [Н/м]
Отсюда мы можем вывести формулу коэффициента поверхностного натяжения.
Коэффициент поверхностного натяжения — это физическая величина, которая характеризует данную жидкость и численно равна отношению поверхностной энергии к площади свободной поверхности жидкости.
Коэффициент поверхностного натяжения
σ = W/S
W — поверхностная энергия жидкости [Дж]
S — площадь свободной поверхности [м2]
σ — коэффициент поверхностного натяжения [Н/м]
Коэффициент поверхностного натяжения жидкости зависит:
- от природы жидкости;
- температуры жидкости;
- свойств газа, который граничит с данной жидкостью;
- наличия поверхностно-активных веществ (например, мыло или стиральный порошок), которые уменьшают поверхностное натяжение.
Коэффициент поверхностного натяжения не зависит от площади свободной поверхности жидкости, хотя может быть рассчитан с ее помощью.
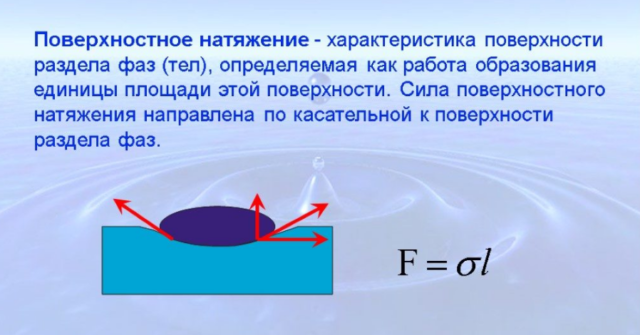
Если на жидкость не действуют другие силы или их действие мало, жидкость будет стремиться принимать форму сферы, как капля воды или мыльный пузырь. Так же ведет себя вода в невесомости. Жидкость ведет себя так, как будто по касательной к ее поверхности действуют силы, стягивающие эту поверхность. Эти силы называются силами поверхностного натяжения.
Сила поверхностного натяжения
F = σl
F — сила поверхностного натяжения [Н]
l — длина контура, ограничивающего поверхность жидкости [м]
σ — коэффициент поверхностного натяжения [Н/м]
В химической промышленности в воду часто добавляют специальные реагенты-смачиватели, не дающие ей собираться в капли на какой-либо поверхности. Например, их добавляют в жидкие средства для посудомоечных машин. Попадая в поверхностный слой воды, молекулы таких реагентов заметно ослабляют силы поверхностного натяжения, вода не собирается в капли и не оставляет на поверхности пятен после высыхания.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
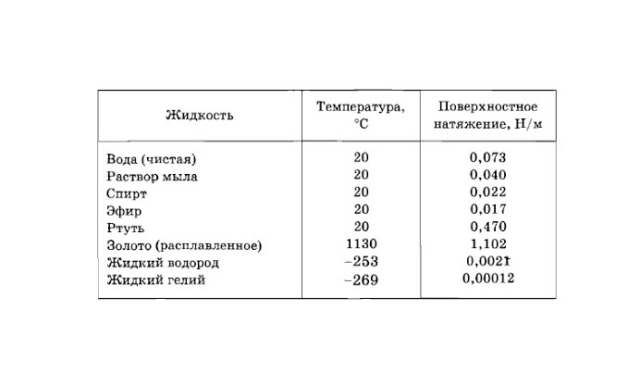
Поверхностное натяжение некоторых жидкостей на границе с воздухом
|
Вещество |
Температура, °C |
Поверхностное натяжение, 10−3 Н/м |
|
Хлорид натрия (водный раствор) |
20 |
82,55 |
|
Хлорид натрия |
801 |
115 |
|
Глицерин |
30 |
64,7 |
|
Олово |
400 |
518 |
|
Азотная кислота 70% |
20 |
59,4 |
|
Анилин |
20 |
42,9 |
|
Ацетон |
20 |
23,7 |
|
Бензол |
20 |
29,0 |
|
Вода |
20 |
72,86 |
|
Глицерин |
20 |
59,4 |
|
Нефть |
20 |
26 |
|
Ртуть |
20 |
486,5 |
|
Серная кислота 85% |
20 |
57,4 |
|
Спирт этиловый |
20 |
22,8 |
|
Уксусная кислота |
20 |
27,8 |
|
Этиловый эфир |
20 |
16,9 |
|
Раствор мыла |
20 |
43 |
Пример решения задачи
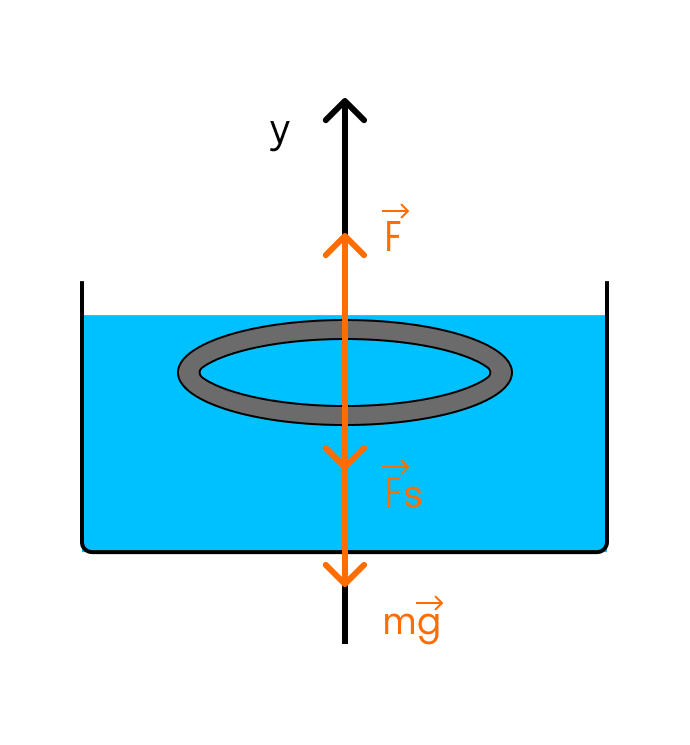
Тонкое алюминиевое кольцо радиусом 7,8 см соприкасается с мыльным раствором. Каким усилием можно оторвать кольцо от раствора? Температуру раствора считать комнатной. Масса кольца 7 г. Коэффициент поверхностного натяжения мыльного раствора при комнатной температуре равен 4 × 10-2 Н/м.
Решение
Выполним рисунок:
На кольцо действуют сила тяжести, сила поверхностного натяжения и внешняя сила, с которой отрывают кольцо от раствора.
Так как кольцо соприкасается с раствором и внешней и внутренней сторонами, то сила поверхностного натяжения удваивается:
Fs = 2σl
Контур, ограничивающий поверхность жидкости, имеет форму окружности. Значит, его длина будет равна:
l = 2πR
Подставляем в формулу силы поверхностного натяжения:
Fs = 4σπR
Условие отрыва кольца от поверхности раствора имеет вид второго закона Ньютона для инерциальных систем отсчета:
F = mg + Fs
Подставляем силу поверхностного натяжения:
F = mg + 4σπR
И вычисляем:
F = 0,007 × 10 + 4 × 4 × 10-2 × 3,14 × 7,8 × 10-2 = 0,11 Н
Ответ: Для того, чтобы оторвать кольцо от раствора, необходимо приложить силу в 0,11 Н.
Важность поверхностного натяжения
Выше мы уже показали, что поверхностное натяжение встречается в повседневной жизни достаточно часто. Но на самом деле оно встречается еще чаще!
В некоторых отраслях промышленности поверхностное натяжение используют как простой показатель загрязнения продуктов. Поскольку оно определяется на молекулярном уровне, любое изменение компонентов вещества может привести к изменению этого показателя. То есть если мы знаем, каким должно быть поверхностное натяжение совершенно чистого вещества, то по отклонению от этой нормы мы можем установить уровень его загрязнения.
Не только человек, но и представители живой природы используют физические явления в своих целях. Например, за счет поверхностного натяжения насекомые водомерки могут перемещаться по водной глади, не промочив лапки. Конечности водомерки отталкивают воду и захватывают воздух, что позволяет насекомым продавливать поверхность воды, не нарушая ее.
За счет поверхностного натяжения возникает такое любопытное явление, как ламинарное течение. Это упорядоченный режим течения вязкой жидкости или газа, при котором соседние слои жидкости не перемешиваются. Выглядит ламинарная струя так, как будто вода застыла.
И это еще не все: поверхностное натяжение позволяет предметам плавать, благодаря ему выживают и развиваются экосистемы, и даже состав воды стабилен только за счет этого явления. Без него вода бы постоянно находилась на границе двух агрегатных состояний: испарялась и вновь конденсировалась, так как молекулы легко выскакивали бы с ее поверхности.
Онлайн-курсы физики в Skysmart не менее увлекательны, чем наши статьи!
$begingroup$
I’m working on a project and I need to reduce the surface tension of water.
I want you to tell me a way in order to reduce surface tension of water except changing the temperature.
asked Nov 27, 2015 at 7:22
$endgroup$
3
$begingroup$
Reduction of surface tension of water can be done in several ways. A few of them are as follows:
Surfactants are compounds that lower the surface tension of a liquid like water, the interfacial tension between two liquids, or that between a liquid and a solid. Surfactants may act as detergents, wetting agents, emulsifiers, foaming agents, and dispersants.
- Surface tension can change with the change with medium that is just above the liquid. For instance, If the medium is air the surface tension of water is $72 times 10^{-3},mathrm{N/m}$, but if the medium is vapour that will be $70 times 10^{-3},mathrm{N/m}$
- If there is any oil or oily compounds on the free surface of the water, then surface tension will be reduced.
- If you mix something to the water, then the surface tension will be changed.
- If you electrify the water then surface tension will be reduced.
Quoting from this link,
Existing surfactants can lower it either as a monomolecular layer on water surface (Langmuir monolayers) or by forming microemulsions. In the former, the bulk water composition is unchanged but the surface tension can be reduced from $72,mathrm{mN/m}$ to only about $20,mathrm{mN/m}$. The microemulsion can make the interfacial tension go to $1,mathrm{mu N/m}$ but changes the water composition. We have shown, through measurement of capillary wave amplitudes using diffuse scattering of X-rays, that a bi-molecular layer of a three-tailed amphiphile, preformed ferric stearate (FeSt), on water surface , lowers the surface tension to about $1,mathrm{mN/m}$.
answered Nov 27, 2015 at 7:48
SchrodingersCatSchrodingersCat
4,8463 gold badges20 silver badges47 bronze badges
$endgroup$
$begingroup$
A simple method is to lead the water with a another fluid with very low IFT ie. wets the material readily such as IPA. This is a standard method used where hydrophobic filter membranes will not wet with water initially, but with the addition of IPA initially it prewets eg PTFE or PVDF and then allows water to displace the IPA and flow without the classic high (2 Bar) bubble point being generated at the interface of the tightly woven polymeric material. Hope this helps as it is very good lab cheat method of wetting the almost unwettable.
Caustic solutions like detergents also may demonstrate very low IFTs (interfacial tension) with other substances, forming very stable emulsions in oils and so forth. RD.
answered Oct 19, 2016 at 4:00
$endgroup$
1
$begingroup$
When the surface of aquarium water is disturbed, the rate of gas exchange between the water and the air is increased; more carbon dioxide is released into the atmosphere and more dissolved oxygen is taken by the water. The surface tension of the water must be broken for sufficient gas exchange.
Fortunately, creating surface agitation is easily done with aeration, or pumping air into the water so that it forms bubbles. The bubbles rise to the surface and burst, thus breaking the surface tension.
answered Apr 3, 2017 at 21:22
$endgroup$
$begingroup$
I’m working on a project and I need to reduce the surface tension of water.
I want you to tell me a way in order to reduce surface tension of water except changing the temperature.
asked Nov 27, 2015 at 7:22
$endgroup$
3
$begingroup$
Reduction of surface tension of water can be done in several ways. A few of them are as follows:
Surfactants are compounds that lower the surface tension of a liquid like water, the interfacial tension between two liquids, or that between a liquid and a solid. Surfactants may act as detergents, wetting agents, emulsifiers, foaming agents, and dispersants.
- Surface tension can change with the change with medium that is just above the liquid. For instance, If the medium is air the surface tension of water is $72 times 10^{-3},mathrm{N/m}$, but if the medium is vapour that will be $70 times 10^{-3},mathrm{N/m}$
- If there is any oil or oily compounds on the free surface of the water, then surface tension will be reduced.
- If you mix something to the water, then the surface tension will be changed.
- If you electrify the water then surface tension will be reduced.
Quoting from this link,
Existing surfactants can lower it either as a monomolecular layer on water surface (Langmuir monolayers) or by forming microemulsions. In the former, the bulk water composition is unchanged but the surface tension can be reduced from $72,mathrm{mN/m}$ to only about $20,mathrm{mN/m}$. The microemulsion can make the interfacial tension go to $1,mathrm{mu N/m}$ but changes the water composition. We have shown, through measurement of capillary wave amplitudes using diffuse scattering of X-rays, that a bi-molecular layer of a three-tailed amphiphile, preformed ferric stearate (FeSt), on water surface , lowers the surface tension to about $1,mathrm{mN/m}$.
answered Nov 27, 2015 at 7:48
SchrodingersCatSchrodingersCat
4,8463 gold badges20 silver badges47 bronze badges
$endgroup$
$begingroup$
A simple method is to lead the water with a another fluid with very low IFT ie. wets the material readily such as IPA. This is a standard method used where hydrophobic filter membranes will not wet with water initially, but with the addition of IPA initially it prewets eg PTFE or PVDF and then allows water to displace the IPA and flow without the classic high (2 Bar) bubble point being generated at the interface of the tightly woven polymeric material. Hope this helps as it is very good lab cheat method of wetting the almost unwettable.
Caustic solutions like detergents also may demonstrate very low IFTs (interfacial tension) with other substances, forming very stable emulsions in oils and so forth. RD.
answered Oct 19, 2016 at 4:00
$endgroup$
1
$begingroup$
When the surface of aquarium water is disturbed, the rate of gas exchange between the water and the air is increased; more carbon dioxide is released into the atmosphere and more dissolved oxygen is taken by the water. The surface tension of the water must be broken for sufficient gas exchange.
Fortunately, creating surface agitation is easily done with aeration, or pumping air into the water so that it forms bubbles. The bubbles rise to the surface and burst, thus breaking the surface tension.
answered Apr 3, 2017 at 21:22
$endgroup$
Поверхностное натяжение.
Это
напряженное состояние поверхностного
слоя жидкости, вызванное силами
взаимодействия между молекулами,
находящимися в верхнем слое жидкости.
рис.19
Сила
поверхностного натяжения
– горизонтальная составляющая всех
сил, действующих на молекулу, находящуюся
в поверхностном слое жидкости.
Рассмотрим
молекулу жидкости, находящуюся в
поверхностном слое, и другую молекулу,
которая находится внутри объема
жидкости(рис.19). Равнодействующая всех
сил, действующих на молекулу, находящуюся
внутри объема жидкости, равна нулю, так
как эта молекула со всех сторон окружена
такими же молекулами, и между ними
действуют силы взаимного притяжения.
А равнодействующая всех сил, действующих
на молекулу, находящуюся в поверхностном
слое жидкости, не равна нулю и направлена
внутрь объема жидкости. Это объясняется
тем, что сверху молекула поверхностного
слоя жидкости окружена молекулами
воздуха, расстояние между которыми
значительно больше чем расстояние между
молекулами жидкости, а значит и силы
притяжения между молекулами воздуха и
жидкости меньше сил взаимодействия
между молекулами самой жидкости, которыми
рассматриваемая молекула окружена
снизу. Поэтому каждая молекула
поверхностного слоя жидкости втягивается
внутрь объема жидкости, и, таким образом,
на поверхности создается особый слой
молекул, находящийся в напряженном
состоянии.
Пленка
поверхностного натяжения всегда
стремится сократить площадь поверхности.
— коэффициент
поверхностного натяжения
— длина контура,
ограничивающего поверхность жидкости
Поверхностно
активные вещества
Существуют такие
вещества, называемые поверхностно
активными, которые могут изменять
коэффициент поверхностного натяжения
жидкостей. К таким веществам относятся,
например, мыло, которое уменьшает
коэффициент поверхностного натяжения
воды. Также по отношению к воде поверхностно
активными являются нефть, спирт, эфир
и многие другие жидкие и твердые вещества.
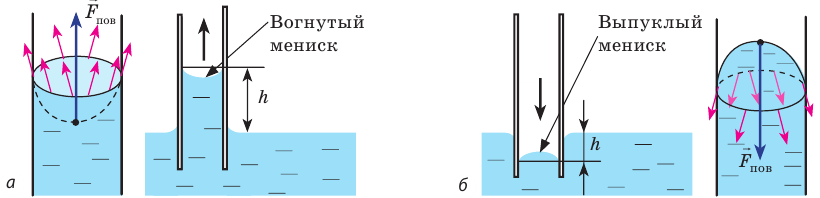
1.2. Жидкость в капиллярах.
Капиллярные
явления. Капиллярами
называют сосуды с маленьким поперечным
сечением (внутренний диаметр меньше
1мм). Важная особенность капилляров
заключается в том, что поверхность
жидкости в них искривлена за счет
смачивания и несмачивания.
Искривленная
форма поверхности жидкости в капиллярной
трубке носит название мениска.
Мениск
в зависимости от смачивания несмачивания
бывает соответственно:
вогнутым
и выпуклым
Изогнутость
поверхности жидкости в капилляре
обусловлена поверхностным натяжением.
с
несмачивание
рис.20
Под
искривленной поверхностью жидкости в
капилляре действует добавочное давление,
обусловленное поверхностным натяжением.
Добавочное давление стремится сделать
изогнутую поверхность жидкости плоской.
Кроме
того, действует гидравлическое или
нормальное давление – давление жидкости
на дно сосуда. Нормальное давление
направлено всегда вниз, к дну сосуда. А
дополнительное давление при смачивании
направлено вверх. Поэтому в капиллярной
трубке при смачивании гидравлическое
давление меньше на величину
.
И, чтобы скомпенсировать действие
дополнительного давления, жидкость в
капилляре поднимается на определенную
высоту (рис.20). При несмачивании
дополнительное давление направлено
вниз и совпадает с гидравлическим.
Поэтому это давление больше на величину.
Не смачиваемая жидкость опускается в
капилляре на некоторую высоту, чтобы
скомпенсировать действие добавочного
давления. Высота поднятия смачивающей
жидкости в капилляре определяется по
формуле:
Борелли-Жюрена
Высота
зависит от поверхности натяжения, от
рода жидкости, от радиуса капилляра.
Добавочное
давление под искривленной поверхностью
жидкости определяется по формуле
Лапласса.
и
— радиусы кривизны двух взаимно
перпендикулярных сечений поверхности
жидкости.
Если
поверхность жидкости имеет сферическую
форму, то формула Лапласа принимает
вид:
Дополнительное
давление под искривленной поверхностью
жидкости прямо пропорционально
коэффициенту поверхностного натяжения
жидкости и обратно пропорционально
радиусу кривизны поверхности жидкости.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Содержание:
Поверхностное натяжение жидкости:
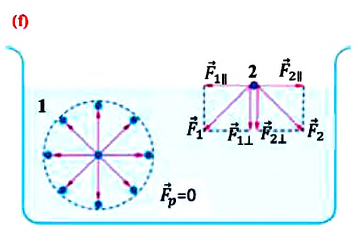
В отличие от газов жидкости имеют свободную поверхность. Молекулы, расположенные на поверхности жидкости, и молекулы внутри жидкости находятся в разных условиях:
a) молекулы внутри жидкости окружены другими молекулами жидкости со всех сторон. Молекула 1 внутри жидкости испытывает действие соседних молекул со всех сторон, поэтому равнодействующая сил притяжения, действующих на нее, равна нулю (f; молекула 1);
b) молекулы на поверхности жидкости испытывают действие со стороны соседних молекул жидкости только сбоку и снизу. Притяжение со стороны молекул газа (пара жидкости или воздуха) над жидкостью во много раз слабее, чем со стороны молекул жидкости, поэтому не принимаются во внимание (f; молекула 2). В результате каждая из равнодействующих сил
Сила поверхностного натяжения
Сила поверхностного натяжения — это сила, направленная по касательной к поверхности жидкости, перпендикулярно к линии, ограничивающей поверхность жидкости, и стремящаяся сократить площадь поверхности жидкости. Сила поверхностного натяжения прямо пропорциональна длине границы соприкосновения свободной поверхности жидкости с твердым телом:
Здесь 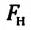
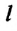
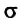
Коэффициент поверхностного натяжения
Коэффициент поверхностного натяжения — численно равен силе поверхностного натяжения, приходящейся на единицу длины линии, ограничивающей поверхность жидкости:
Значение коэффициента поверхностного натяжения зависит от вида жидкости и ее температуры, то есть с увеличением температуры жидкости коэффициент его поверхностного натяжения уменьшается и при критической температуре равен нулю. Единица коэффициента поверхностного натяжения в СИ:
Смачивающая и несмачивающая жидкость. При внимательном рассмотрении можно увидеть искривление поверхности жидкости на границе между жидкостью и твердым телом.
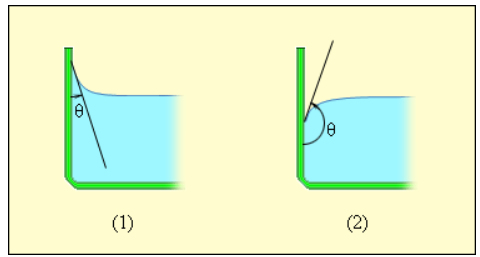
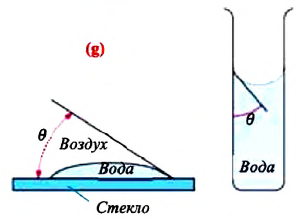
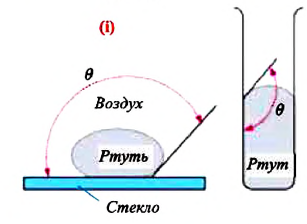
Мениск — это искривление свободной поверхности жидкости в месте ее соприкосновении с поверхностью твердого тела (или другой жидкости). Угол между поверхностью мениска и поверхностью твердого тела называется краевым углом.
Значение краевого угла 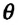
Смачивающая жидкость —это жидкость, у которой краевой угол острый. Сила взаимного притяжения между молекулами смачивающей жидкости и твердого тела больше, чем силы взаимного притяжения между молекулами самой жидкости. В результате свободная поверхность жидкости в сосуде становится вогнутой, например, вода в стеклянном сосуде — смачивающая жидкость (g).
Несмачивающая жидкость — это жидкость, у которой краевой угол тупой. Сила взаимного притяжения между молекулами несмачивающей жидкости и твердого тела меньше, чем сила взаимного притяжения между молекулами самой жидкости. В результате свободная поверхность жидкости в сосуде бывает выпуклой, например, ртуть в стеклянном сосуде — несмачивающая жидкость (i).
Капиллярные явления
В повседневной жизни встречаются и используются тела, с легкостью впитывающие в себя воду, например, полотенце, промокательная бумага, сахар, кирпич, растения и др. Это свойство в телах объясняется существованием в них большого количества очень узких трубочек — капилляров.
Капилляр — это узкая трубка (канал) диаметром меньше 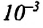
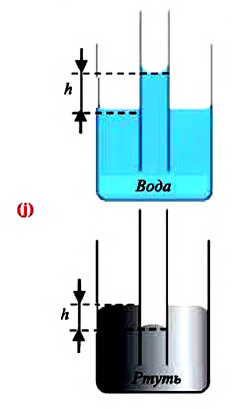
Капиллярными явлениями называют явления подъема смачивающей и опускания несмачивающей жидкости по капилляру относительно общего уровня жидкости под действием сил поверхностного натяжения (j).
В таблице 6.4 дана зависимость между величинами, характеризующими жидкость, поднимающуюся в капилляре.
Таблица 6.4
|
Характеристики жидкости, поднимающейся в капилляре |
Формула |
| Вес жидкости, поднимающейся в капилляре |
Где |
| Масса жидкости, поднимающейся в капилляре | 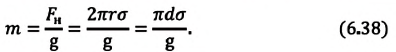 |
| Высота жидкости, поднимающейся в капилляре |
Если жидкость полностью смачиваемая, то получаем в Где |
| Давление жидкости, поднимающейся в капилляре | 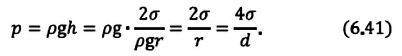 |
Поверхностное натяжение жидкости
Некоторые виды пауков могут передвигаться по поверхности воды не проваливаясь, как будто эта поверхность покрыта невидимой тонкой пленкой. такое же впечатление создается, если наблюдать за вытеканием воды из маленького отверстия — вода течет не тоненькой струйкой, а образует капли. Бумажная салфетка впитывает воду, едва коснувшись ее поверхности. какая сила является причиной всех этих явлений?
Каковы особенности поверхностного слоя жидкости
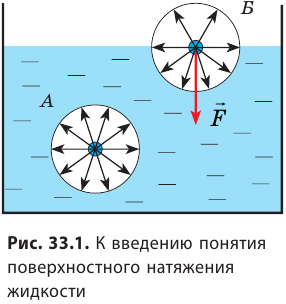
На свободной поверхности жидкости молекулы находятся в особых условиях, отличающихся от условий, в которых находятся молекулы внутри жидкости. Рассмотрим две молекулы — А и Б (рис. 33.1): молекула А находится внутри жидкости, а молекула Б — на ее поверхности. Молекула А окружена другими молекулами жидкости равномерно, поэтому силы, действующие на молекулу А со стороны молекул, попадающих в сферу межмолекулярного взаимодействия, скомпенсированы, то есть их равнодействующая равна нулю.
Молекула Б с одной стороны окружена молекулами жидкости, а с другой — молекулами газа. Со стороны жидкости на нее действует гораздо больше молекул, чем со стороны газа, поэтому равнодействующая F межмолекулярных сил направлена в глубь жидкости. Чтобы молекула из глубины попала в поверхностный слой, нужно совершить работу против межмолекулярных сил. Это означает, что молекулы поверхностного слоя жидкости (по сравнению с молекулами внутри жидкости) обладают избыточной потенциальной энергией. Эта избыточная энергия является частью внутренней энергии жидкости и называется поверхностной энергией (Wпов). Очевидно, что чем больше площадь S поверхности жидкости, тем больше поверхностная энергия: W S пов = σ , где σ (сигма) — коэффициент пропорциональности, который называют поверхностным натяжением жидкости.
Поверхностное натяжение жидкости — физическая величина, которая характеризует данную жидкость и равна отношению поверхностной энергии к площади поверхности жидкости:
Единица поверхностного натяжения в СИ — ньютон на метр:
Поверхностное натяжение жидкости определяется силами межмолекулярного взаимодействия, поэтому оно зависит:
- от природы жидкости: у летучих жидкостей (эфир, спирт, бензин) поверхностное натяжение меньше, чем у нелетучих (ртуть, жидкие металлы);
- температуры жидкости: чем выше температура жидкости, тем меньше поверхностное натяжение;
- присутствия в составе жидкости поверхностно активных веществ — их наличие уменьшает поверхностное натяжение;
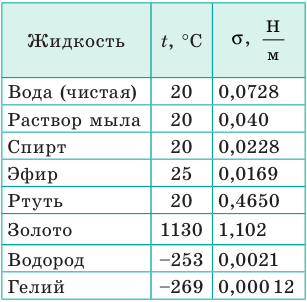
- свойств газа, с которым жидкость граничит. В таблицах обычно приводят значение поверхностного натяжения на границе жидкости и воздуха при определенной температуре (табл. 1).
Таблица 1
Поверхностное натяжение σ некоторых жидкостей
Что такое сила поверхностного натяжения
Поскольку поверхностный слой жидкости обладает избыточной потенциальной энергией (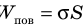
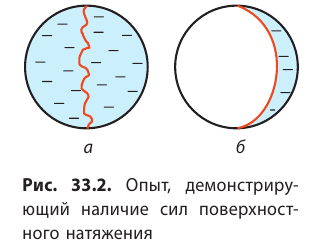
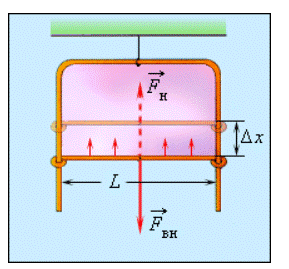
Наличие сил поверхностного натяжения делает поверхность жидкости похожей на натянутую резиновую пленку, однако упругие силы в резиновой пленке зависят от площади ее поверхности (от того, насколько пленка деформирована), а поверхность жидкости всегда «натянута» одинаково, то есть силы поверхностного натяжения не зависят от площади поверхности жидкости. Наличие сил поверхностного натяжения можно доказать с помощью такого опыта. Если проволочный каркас с закрепленной на нем нитью опустить в мыльный раствор, каркас затянется мыльной пленкой, а нить приобретет произвольную форму (рис. 33.2, а).
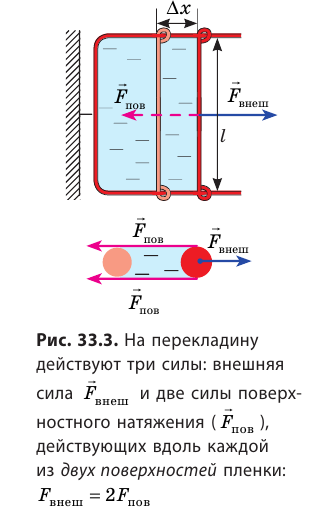
Если осторожно проткнуть иглой мыльную пленку по одну сторону от нити, сила поверхностного натяжения мыльного раствора, действующая с другой стороны, натянет нить (рис. 33.2, б). Опустим в мыльный раствор проволочную рамку, одна из сторон которой подвижна. На рамке образуется мыльная пленка (рис. 33.3). Будем растягивать эту пленку, действуя на перекладину (подвижную сторону рамки) с некоторой силой 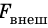
Если под действием этой силы перекладина переместится на ∆x , то внешние силы совершат работу: 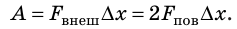
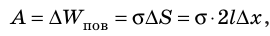
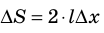
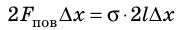
Таким образом, поверхностное натяжение σ численно равно силе поверхностного натяжения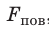
С одним из методов определения поверхностного натяжения жидкости вы ознакомитесь, выполняя лабораторную работу № 7.
- Заказать решение задач по физике
Где проявляется поверхностное натяжение
В жизни вы постоянно сталкиваетесь с проявлениями сил поверхностного натяжения. Так, благодаря ему на поверхности воды удерживаются легкие предметы (рис. 33.4) и некоторые насекомые.
Рис. 33.4. Монетка удерживается на поверхности воды благодаря силе поверхностного натяжения. (Чтобы провести такой опыт, монетку нужно потереть между пальцев и осторожно опустить на поверхность воды.)
Когда вы ныряете, ваши волосы расходятся во все стороны, но как только вы окажетесь над водой, волосы слипнутся, так как в этом случае площадь свободной поверхности воды намного меньше, чем при раздельном расположении прядей в воде. По этой же причине можно лепить фигуры из влажного песка: вода, обволакивая песчинки, прижимает их друг к другу.
Рис. 33.5. Капля удерживается около небольшого отверстия до тех пор, пока сила поверхностного натяжения уравновешивает силу тяжести
Стремлением жидкости уменьшить площадь поверхности объясняется и тот факт, что в условиях невесомости вода принимает форму шара, — при заданном объеме шарообразной форме соответствует наименьшая площадь поверхности. Форму шара приобретают тонкие мыльные пленки (мыльные пузыри). Поверхностным натяжением объясняется образование пены: пузырек газа, достигнув поверхности жидкости, имеет над собой тонкий слой жидкости; если пузырек мал, то архимедовой силы недостаточно, чтобы разорвать двойной поверхностный слой, и пузырек «застревает» вблизи поверхности. Благодаря поверхностному натяжению жидкость не выливается из маленького отверстия тоненькой струйкой, а капает (рис. 33.5), дождь не проливается через ткань зонта или палатки и т. д.
Почему одни жидкости собираются в капли, а другие растекаются
Наличие сил поверхностного натяжения проявляется в сферической форме мелких капелек росы, в каплях воды, разбегающихся по раскаленной плите, в капельках ртути на поверхности стекла. Однако при соприкосновении с твердым телом сферическая форма капли, как правило, не сохраняется. Форма свободной поверхности жидкости зависит также от сил взаимодействия молекул жидкости с молекулами твердого тела.
Если силы взаимодействия между молекулами жидкости больше, чем силы взаимодействия между молекулами жидкости и твердого тела, жидкость не смачивает поверхность твердого тела (рис. 33.6). Например, ртуть не смачивает стекло, а вода не смачивает покрытую сажей поверхность.
Рис. 33.6. Капля несмачивающей жидкости принимает форму, близкую к сферической, а поверхность жидкости вблизи стенки сосуда является выпуклой
Если же капельку ртути поместить на цинковую пластину, то капелька будет стремиться растечься по поверхности пластины; так же ведет себя и капелька воды на стекле (рис. 33.7). Если силы взаимодействия между молекулами жидкости меньше сил взаимодействия между молекулами жидкости и твердого тела, жидкость смачивает поверхность твердого тела.
Рис. 33.7. Капля смачивающей жидкости стремится растечься по поверхности твердого тела, а вблизи стенки сосуда поверхность жидкости принимает вогнутую форму
Почему жидкость поднимается в капиллярах
В природе часто встречаются тела, пронизанные многочисленными мелкими капиллярами (от лат. capillaris — волосяной) — узкими каналами произвольной формы. Такую структуру имеют бумага, дерево, почва, многие ткани и строительные материалы. В цилиндрических капиллярах искривленная поверхность жидкости представляет собой часть сферы, которую называют мениском. У смачивающей жидкости образуется вогнутый мениск (рис. 33.8, а), а у несмачивающей — выпуклый (рис. 33.8, б).
Рис. 33.8. капиллярные явления: а — смачивающая жидкость поднимается по капилляру; б — несмачивающая жидкость опускается в капилляре
Поверхность жидкости стремится к минимуму потенциальной энергии, а искривленная поверхность обладает большей площадью по сравнению с площадью сечения капилляра, поэтому поверхность жидкости стремится выровняться и под ней возникает избыточное (отрицательное или положительное) давление — лапласово давление (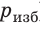
Под вогнутой поверхностью (жидкость смачивает капилляр) лапласово давление отрицательное и жидкость втягивается в капилляр. Так поднимаются влага и питательные вещества в стеблях растений, керосин по фитилю, влага в почве. Вследствие лапласового давления салфетки или ткань впитывают воду, брюки в дождливую погоду сильно намокают снизу и т. д. Под выпуклой поверхностью (жидкость не смачивает капилляр) лапласово давление положительное и жидкость в капилляре опускается. Чем меньше радиус капилляра, тем больше высота подъема (или опускания) жидкости (см. задачу ниже).
Пример решения задачи
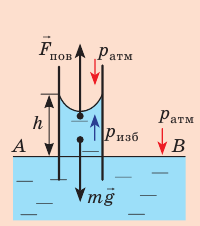
Капиллярную трубку радиусом r одним концом опустили в жидкость, смачивающую внутреннюю поверхность капилляра. На какую высоту поднимется жидкость в капилляре, если плотность жидкости ρ, а ее поверхностное натяжение σ ? Чему равно лапласово давление под вогнутой поверхностью капилляра? Смачивание считайте полным.
Решение:
На жидкость в капилляре действуют сила тяжести и сила поверхностного натяжения (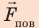
Поиск математической модели, решение
Поскольку m V = ρ , а объем воды в цилиндрическом капилляре 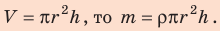
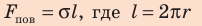
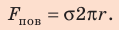
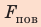

где R — радиус кривизны мениска (при полном смачивании r=R).
Ответ: (Данные выводы следует запомнить!)
Выводы:
- Свойства паров в физике
- Кипение жидкостей в физике
- Электромагнитные явления в физике
- Электромагнитные волны и их свойства
- Расчет количества теплоты при нагревании и охлаждении
- Удельная теплота сгорания топлива
- Плавление и кристаллизация в физике
- Испарение жидкостей в физике
Коэффициент поверхностного натяжения
Определение и формула коэффициента поверхностного натяжения
Имеется другое определение коэффициента поверхностного натяжения — энергетическое. Оно исходит из того, что если площадь поверхности жидкости увеличивается, то некоторое количество молекул из ее объема поднимается на слой поверхности. С этой целью внешние силы совершают работу () против сил сцепления молекул. Величина данной работы будет пропорциональна изменению площади поверхности жидкости (
):
где коэффициентом пропорциональности является коэффициент поверхностного натяжения.
Тогда коэффициент поверхностного натяжения можно определить как физическую величину, равную работе, которая необходима для увеличения площади поверхности жидкости при изотермическом процессе не единицу:
Коэффициент поверхностного натяжения — это положительная физическая величина ().
Молекулы поверхностного слоя жидкости имеют избыточную, в сравнении с молекулами внутренних слоев, потенциальную энергию. Потенциальную энергию поверхностного слоя можно вычислить как:
где S — площадь поверхности жидкости.
Свойства коэффициента поверхностного натяжения
Для чистых жидкостей при увеличении температуры коэффициент поверхностного натяжения уменьшается.
Величина коэффициента связана с силами межмолекулярного взаимодействия. Он может принимать различные значения. У летучих (хорошо испаряющихся) жидкостей
меньше, чем у нелетучих.
Коэффициент поверхностного натяжения воды зависит от концентрации примесей в ней. Так, при добавлении в воду биологически активных веществ (паста, мыло) поверхностное натяжение воды уменьшается.
Коэффициент поверхностного натяжения можно найти, используя капилляры. Для этого капилляр опускают в сосуд с водой и измеряют высоту подъема жидкости (h). При этом коэффициент находят, применяя формулу:
где — плотность жидкости,
— радиус капилляра,
— краевой угол,
— ускорение свободного падения.
Вообще говоря, поверхностное натяжение существует на границе твердых, жидких и газообразных тел. Но чаще рассматривают поверхностное натяжение на границе газ — жидкость.
Коэффициент поверхностного натяжения входит в известную формулу Лапласа, которая определяет добавочного давление (), которое вызывает кривизна поверхности жидкости:
где и
— радиусы кривизны двух взаимно перпендикулярных сечений поверхности жидкости.
Единицы измерения
Основной единицей измерения коэффициента поверхностного натяжения в системе СИ является:
Н/м = Дж/м2
Примеры решения задач
Поверхностное натяжение жидкости

4.1
Средняя оценка: 4.1
Всего получено оценок: 272.
4.1
Средняя оценка: 4.1
Всего получено оценок: 272.
Жидкости, в отличие от газов, не занимают весь предоставленный объем, а собираются в капли разной величины. Это происходит из-за того, что жидкости обладают особым свойством, отсутствующим у газов, — поверхностным натяжением. Рассмотрим сущность этого явления.
Молекулярное строение жидкости
В 10 классе известно, что в молекулах любого вещества имеются положительно и отрицательно заряженные области. При этом, поскольку молекулы находятся в постоянном хаотичном движении, они обладают некоторой кинетической энергией. Совместное действие этих факторов определяет агрегатное состояние вещества.
При сближении молекул главную роль играют силы отталкивания одинаково заряженных областей. Если кинетическая энергия достаточно высока, то молекулы стремятся удалиться друг от друга. Именно так ведет себя газ.
Если кинетическая энергия сравнительно мала, то главную роль играют силы притяжения, и молекулы максимально приближаются друг к другу, находясь на энергетически выгодных расстояниях. Для изменения этих расстояний (в любую сторону) требуется затрачивать энергию. Так ведут себя твердые вещества.
Наконец, в жидкостях молекулы располагаются на близком расстоянии, однако их кинетическая энергия достаточна, чтобы постоянно менять свое положение.
Поверхностная энергия жидкости
Если рассмотреть молекулы жидкости, то можно увидеть, что молекулы в глубине и на поверхности жидкости находятся в различных энергетических условиях.
В глубине жидкости на молекулу действует давление всех окружающих ее молекул, силы отталкивания уравновешивают его на меньших расстояниях, по сравнению с молекулой на поверхности.
Получается, что у молекул на поверхности имеется некоторая избыточная потенциальная энергия, по сравнению с молекулами в глубине. Эта энергия называется поверхностной.
Общая энергия молекул поверхностного слоя складывается из потенциальной энергии отдельных молекул, а значит, пропорциональна их числу. Число молекул поверхностного слоя в свою очередь пропорционально площади поверхности. Следовательно, поверхностная энергия пропорциональна площади поверхности, и для ее определения используют формулу:
$$W_{пов}=sigma S$$
Поверхностное натяжение жидкости
Коэффициент пропорциональности $sigma$ называется коэффициентом поверхностного натяжения. Он равен поверхностной энергии жидкости на единичной ее площади (это его физический смысл) и зависит от свойств жидкости и от температуры.
Как правило, коэффициент поверхностного натяжения выше у более плотных жидкостей. При комнатной температуре наиболее велик он у ртути. Поэтому ртуть, как правило, собирается в шарообразные капельки, хотя вода при таком же объеме растекается.
Если повышать температуру, то кинетическая энергия молекул жидкости будет увеличиваться, и энергетические условия молекул на поверхности и внутри жидкости будут сближаться. При некоторых температуре и внешнем давлении (они называются критическими) поверхностная энергия становится равной нулю, поверхность жидкости исчезает, жидкость становится неотличимой от газа.
Для измерения коэффициента поверхностного натяжения жидкости используется рамка, помещенная в жидкость, связанная с чувствительным динамометром.
При отрыве рамки от поверхности воды динамометр зафиксирует увеличение усилия. Коэффициент поверхностного натяжения будет пропорционален этому усилию и обратно пропорционален длине рамки:
$$sigma = {F_{max} over 2l}$$
Коэффициенты поверхностного натяжения некоторых жидкостей приведены в таблице:
Что мы узнали?
Молекулы на поверхности жидкости находятся на немного бо́льших расстояниях друг от друга, по сравнению с молекулами в глубине. Поэтому они обладают некоторой поверхностной энергией. Эта энергия является источником поверхностного натяжения жидкостей, благодаря ей жидкость всегда стремится собраться в капли.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.1
Средняя оценка: 4.1
Всего получено оценок: 272.
А какая ваша оценка?
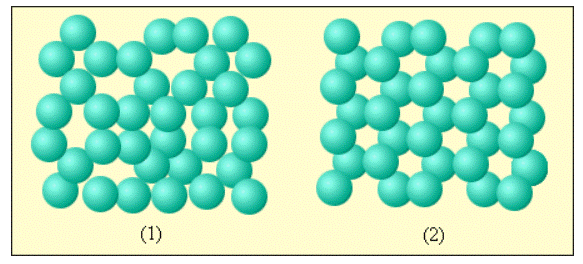
Вещество, находящееся в жидком состоянии, характеризуется крайне плотным расположением молекул друг относительно друга. Отличаясь от твердых кристаллических тел, чьи молекулы формируют упорядоченные структуры по всему объему кристалла и ограничены в своих тепловых колебаниях фиксированными центрами, молекулы жидкости обладают значительной степенью свободы. Любая конкретная молекула жидкого вещества, как это происходит и в твердых телах, «зажата» соседними молекулами и может совершать тепловые колебания поблизости с некоторым положением равновесия. Несмотря на это, в какой-то момент, любая молекула может переместиться на соседнее вакантное место. Подобные перемещения в жидкостях происходят довольно часто, благодаря чему молекулы не привязаны к конкретным центрам, как в кристаллах, а имеют возможность перемещаться по всему объему жидкости. Именно на этом факте основывается текучесть жидкостей.
По причине сильного взаимодействия между близко расположенными молекулами они могут образовывать локальные, то есть неустойчивые, упорядоченные группы, включающие в себя несколько молекул. Данное явление носит название ближнего порядка (рис. 3.5.1).
Рисунок 3.5.1. Пример ближнего порядка молекул жидкости и дальнего порядка молекул кристаллического вещества: 1 – вода; 2 – лед.
Свойства жидкостей
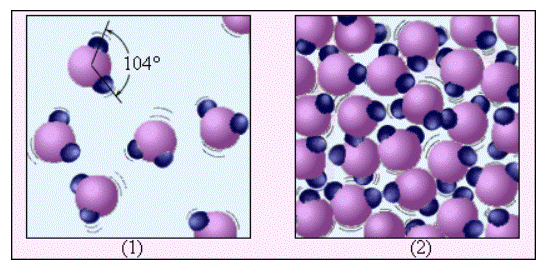
На рисунке 3.5.2, на примере воды, проиллюстрировано различие между газообразным веществом и жидкостью. Молекула воды H2O включает в свой состав один атом кислорода и два атома водорода, которые расположены под углом 104°. В среднем, расстояние между молекулами пара в десятки раз больше, чем между молекулами воды. На рисунке 3.5.2, в отличие от рисунка 3.5.1, на котором молекулы воды представляют из себя шарики, дается представление о структуре молекулы воды.
Рисунок 3.5.2. Водяной пар (1) и вода (2). Молекулы воды увеличены примерно в 5·107 раз.
Сжимаемость жидкостей, то есть изменение объема вещества при изменении давления, по причине плотности расположения молекул в десятки и сотни тысяч раз меньше, чем сжимаемость газов. К примеру, чтобы изменить объем воды всего на 1 % необходимо повысить значение давления примерно в 200 раз. Подобное увеличение давления по сравнению с атмосферным достигается на глубине близкой к 2 км.
Подобно твердым телам, жидкости имеют свойство менять свой объем при изменении температуры. В случае не самых больших интервалов температур относительное изменение объема ΔVV0 пропорционально изменению температуры ΔT, что может быть записано в виде следующего соотношения:
ΔVV0=β∆T.
В котором коэффициент β представляет собой температурный коэффициент объемного расширения. Данный коэффициент у жидкостей в десятки раз превышает значение такого же у твердых тел.
К примеру, у воды в случае, если температура равна 20 °С βв≈2·10–4 К–1, у стали βст≈3,6·10–5 К–1, у кварцевого стекла βкв≈9·10–6 К–1.
Тепловое расширение воды обладает важным для жизни на Земле эффектом. В условиях температуры ниже 4 °С вода начинает расширяется при снижении температуры β<0. Максимальную плотность ρв=103 кг/м3 вода приобретает при температуре 4 °С.
Замерзая, вода расширяется, из-за чего лед продолжает плавать на поверхности замерзающего водоема. Температура замерзающей воды подо льдом эквивалентна величине в 0 °С. У дна водоема, то есть слоях воды, обладающих большей плотностью, температура держится около 4 °С.
Поверхностное натяжение
Наличие свободной поверхности в жидкостях является одной из самых интересных ее особенностей. В отличие от газов, жидкость не заполняет весь объем сосуда, в котором она находится. Между жидкостью и газом, возможно паром, возникает граница раздела, находящаяся в особых условиях по сравнению с остальной массой жидкости. В отличие от молекул в глубине жидкости, молекулы, располагающиеся в пограничном ее слое, окружены другими молекулами этой же жидкости не со всех сторон. В среднем воздействующие на одну из молекул внутри жидкости со стороны соседних молекул силы межмолекулярного взаимодействия взаимно скомпенсированы. Каждая отдельно взятая молекула в пограничном слое притягивается находящимися внутри жидкости молекулами. При этом, силами, которые оказывают воздействие на такую молекулу жидкости со стороны молекул газа можно пренебречь. Вследствие этого возникает некая направленная вглубь жидкости равнодействующая сила. Поверхностные молекулы втягиваются внутрь жидкости, с помощью действия сил межмолекулярного притяжения. Однако все молекулы, в том числе и принадлежащие пограничному слою, должны находиться в состоянии равновесия. Оно достигается за счет сокращения расстояния между молекулами в пограничном слое и ближайшими их соседями в жидкости. Как проиллюстрировано на рисунке 3.1.2, в процессе уменьшения расстояния расстояния между молекулами появляются силы отталкивания. В случае, когда средняя величина расстояния между молекулами в жидкости равна r0, молекулы поверхностного слоя расположены плотнее, и по этой причине по сравнению с внутренними молекулами они имеют дополнительным запас потенциальной энергии, что можно увидеть на рисунке 3.1.2.
Стоит обратить внимание на то, что более плотного поверхностного слоя не приводит к сколь-нибудь заметному изменению объема жидкости по причине чрезвычайно низкой сжимаемости.
Силы межмолекулярного взаимодействия совершают положительную работу, в случае, когда молекула перемещается с поверхности внутрь жидкости. И наоборот, чтобы достать некоторое количество молекул на поверхность из глубины жидкости, то есть повысить площадь поверхности жидкости, внешним силам необходимо произвести пропорциональную изменению ΔS площади поверхности положительную работу ΔAвнеш:
ΔAвнеш=σ∆S,
где коэффициент σ носит название коэффициента поверхностного натяжения (σ>0).
Из всего вышесказанного следует, что коэффициент поверхностного натяжения — это величина равная работе, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу.
В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или же в ньютонах на метр (1 Н/м=1 Дж/м2).
Таким образом, по сравнению с молекулами внутри жидкости молекулы поверхностного слоя жидкости обладают избыточной потенциальной энергией. Потенциальная энергия Eр поверхности жидкости пропорциональна ее площади и выражается в виде следующей формулы:
Eр=Aвнеш=σS.
Из раздела механики известно, что равновесным состояниям системы соответствует минимальное значение ее потенциальной энергии. Следовательно, свободная поверхность жидкости стремится уменьшить свою площадь. По данной причине свободная капля жидкости принимает шарообразную форму.
Жидкость ведет себя таким образом, будто по касательной к ее поверхности действуют сокращающие данную поверхность силы. Такие силы называются силами поверхностного натяжения.
Силы поверхностного натяжения влияют на поверхность жидкости таким образом, что она становится похожей на упругую растянутую пленку, с той лишь разницей, что упругие силы в пленке зависят от площади ее поверхности, то есть от степени деформированности пленки, а силы поверхностного натяжения, зависимости от площади поверхности жидкости не имеют.
Некоторые жидкости, например, мыльная вода, имеют способность формировать тонкие пленки. Хорошо известные каждому человеку мыльные пузыри обладают правильной сферической формой, в чем также проявляется воздействие сил поверхностного натяжения. В случае, когда в мыльный раствор опускают проволочную рамку с одной подвижной стороной, вся она затягивается пленкой жидкости, как это показано на рисунке 3.5.3.
Рисунок 3.5.3. Подвижная сторона проволочной рамки в равновесии под действием внешней силы Fвн→ и результирующей сил поверхностного натяжения Fн→.
Силы поверхностного натяжения действуют на уменьшение поверхности пленки. Ради равновесия подвижной стороны рамки к ней необходимо приложить внешнюю силу
Fвн→=-Fн→. Если воздействие силы Fвн→ спровоцирует перемещение перекладины на некоторое Δx, то будет произведена работа ΔAвн=FвнΔx=ΔEp=σΔS, где ΔS=2LΔx является увеличением площади поверхности обеих сторон мыльной пленки. По той причине, что модули сил Fвн→ и Fн→ эквивалентны, справедливой будет запись:
Fн∆x=σ2L∆x или σ=Fн2L.
Исходя из этого, можно заявить, что коэффициент поверхностного натяжения σ может быть определен как модуль силы поверхностного натяжения, действующей на единицу длины линии, ограничивающей поверхность.
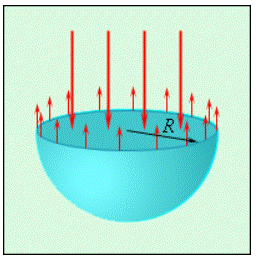
По причине воздействия сил поверхностного натяжения на капли жидкости и их действия внутри мыльных пузырей появляется некоторое избыточное давление Δp. При мысленном разрезании сферической капли с радиусом R на две равные части каждая из половин должна находиться в равновесии под действием приложенных к границе разреза длиной 2πR и сил избыточного давления, действующих на площадь πR2 сечения (рис. 3.5.4) сил поверхностного натяжения. Условие равновесия может быть записано в следующем виде:
σ2πR=∆pπR2.
Исходя из этого, можно заявить, что избыточное давление внутри капли эквивалентно:
∆p=2σR(капля жидкости).
Рисунок 3.5.4. Сечение сферической капли жидкости.
Из-за того, что пленка обладает двумя поверхностями, величина избыточного давления внутри мыльного пузыря в два раза выше, чем в капле:
∆p=4σR(мыльный пузырь).
Пренебрегая взаимодействием с молекулами газа, можно сказать, что поблизости с границей между твердым телом, жидкостью и газом форма свободной поверхности жидкости зависима от сил взаимодействия молекул жидкости с молекулами твердого тела.
В случае, когда данные силы превышают силы взаимодействия между молекулами жидкости, жидкость смачивает поверхность твердого тела. В таком случае жидкость подходит к поверхности твердого тела под некоторым характерным для данной пары жидкость – твердое тело острым углом θ. Такой угол носит название краевого угла.
Краевой угол θ является тупым (рисунок 3.5.5), в случае, если силы взаимодействия между молекулами жидкости превосходят силы их взаимодействия с молекулами твердого тела. В подобном случае можно сказать, что поверхность твердого тела не смачивается жидкостью. В условиях полного смачивания θ=0, полного несмачивания θ=180°.
Рисунок 3.5.5. Краевые углы смачивающей (1) и несмачивающей (2) жидкостей.
Капиллярные явления
Капиллярными явлениями называют процесс подъема или опускания жидкости в трубках малого диаметра, другими словами, в капиллярах.
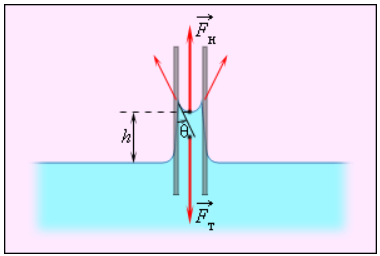
Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются. На рисунке 3.5.6 проиллюстрирована опущенная нижним концом в смачивающую жидкость плотности ρ капиллярная трубка, обладающая некоторым радиусом r. При этом верхний конец капилляра является открытым. Подъем жидкости в капилляре будет происходить до тех пор, пока сила тяжести Fт→, оказывающая воздействие на столб жидкости в капилляре, не станет эквивалентна по модулю результирующей Fн действующих вдоль границы соприкосновения жидкости с поверхностью капилляра сил поверхностного натяжения: Fт=Fн, где Fт=mg=ρhπr2g, Fн=σ2πr cos θ.
Из этого следует:
h=2σ cos θρgr.
Рисунок 3.5.6. Подъем смачивающей жидкости в капилляре.
При полном смачивании θ=0, cos θ=1. В таком случае:
h=2σρgr.
При полном несмачивании θ=180°, cos θ=–1 и, соответственно, h<0. Уровень несмачивающей жидкости в капилляре опускается ниже уровня жидкости в сосуде, в которую опущен капилляр.
Вода почти полностью смачивает чистую поверхность стекла. Ртуть же, строго наоборот, полностью не смачивает стеклянную поверхность. По этой причине уровень ртути в стеклянном капилляре опускается ниже, чем уровень в сосуде.


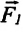


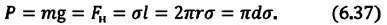
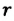 — радиус капилляра,
— радиус капилляра, 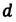 — диаметр капилляра.
— диаметр капилляра.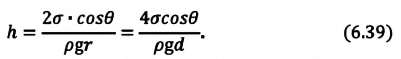
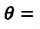

 — плотность жидкости, поднимающейся в капилляре. Высота подъема жидкости в капилляре зависит от рода жидкости и обратно пропорциональна радиусу капилляра.
— плотность жидкости, поднимающейся в капилляре. Высота подъема жидкости в капилляре зависит от рода жидкости и обратно пропорциональна радиусу капилляра.