Содержание
- Что за параметр, в чем измеряется?
- От чего зависит?
- Как меняется от изменения температуры?
- Таблица зависимости
- Как найти?
- Пример
- Использование под избыточным давлением
- Применение в жизни
- Заключение
Что за параметр, в чем измеряется?
Давление насыщенного пара – это давление газообразного вещества, молекулы которого находятся в термодинамическом равновесии с жидкостью, из которой он образовался. В таком состоянии концентрация молекул (плотность) максимальная.
Как и любое другое Р, оно измеряется в Паскалях (Па), атмосферах (атм.) или мм ртутного столба (мм рт. ст.). При заданной температуре Р насыщенного пара всегда больше Р ненасыщенного.
От чего зависит?
Есть всего два фактора, влияющие на значение этого параметра:
- Особенности строения вещества. Для каждой жидкости параметр принимает свое значение. Так, при 20℃ давление насыщенных паров воды в 10 раз меньше хлороформа, и в 100 раз меньше сернистой кислоты.
- Температура. С ростом температуры концентрация молекул газа и их скорость увеличиваются, значит, возрастает давление. С уменьшением температуры давление уменьшается.
Если при постоянной температуре уменьшать объем, в котором находится насыщенный пар, то он начнет конденсироваться – превращаться в воду. Если увеличивать – то испарение возрастет, а концентрация молекул и давление останутся неизменным. То есть давление не зависит от объема. В этом состоит отличие насыщенного пара от обычного.
Для насыщенного пара не работают законы Бойля-Мариотта (изотермический процесс), Гей-Люссака (изобарный) и Шарля (изохорный). Однако можно использовать уравнение Менделеева-Клапейрона.
Как меняется от изменения температуры?
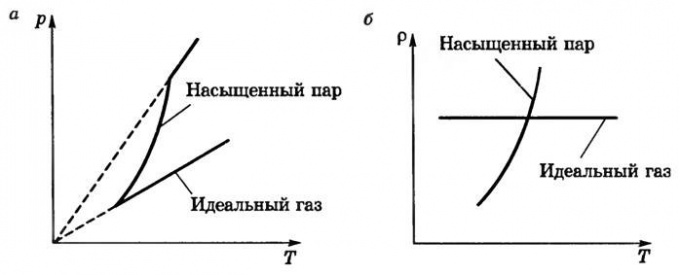
У обычного газа давление зависит от температуры линейно, то есть на графике зависимости p от T будет прямая. У насыщенного пара ситуация другая. С ростом температуры давление растет быстрее, чем у обычного газа.
Это объясняется тем, что при нагревании не только повышается температура, но и увеличивается испарение, то есть возрастает концентрация молекул газа.
На рисунке участок 1-2 показывает, как меняется давление насыщенного пара над водой в закрытом сосуде. Как только жидкость испарится полностью, концентрация молекул газа будет постоянной, и давление начнет изменяться по линейным законам, чему соответствует участок 2-3.
Таблица зависимости
Измерения, полученные экспериментальным путем, заносят в таблицу. Данными пользуются при расчетах, инженерных изысканиях.
| Температура, ℃ | Давление, мм рт. ст. |
| 0 | 4,58 |
| 5 | 6,55 |
| 10 | 9,21 |
| 20 | 17,54 |
| 50 | 92,59 |
| 75 | 289,2 |
| 90 | 525,9 |
| 100 | 760 |
Как видно из таблицы, пар может становиться насыщенным даже при нуле градусов, когда он на границе со своей твердой фазой (льдом). При этом давление его довольно низкое.
При нормальных условиях (при 20 градусах С и 1 атм.) параметр повышается, но все еще незначительно – до 17,54 мм рт. ст. (0,023 атм.). При температуре кипения воды 100 ℃ он равен атмосферному (1 атм.).
Чтобы повысить температуру кипения жидкости, повышают давление в системе. Это явление часто используется на практике.
Как найти?

P*V=n*R*T, где R – универсальная газовая постоянная, равна приблизительно 8,314 Дж/(моль*К).
Используется также понятие относительной влажности. Обозначается греческой буквой «фи»: φ = Р/Рн * 100%.
Давление паров воды, находящихся в воздухе, поделенное на Р насыщенного пара при вполне конкретной температуре. Для удобства части перевели в проценты.
Если относительная влажность равна 100%, то воздух настолько насыщен парами воды, что уже не может их принять.
Пример
Если в закрытом помещении при температуре 10 ℃ относительная влажность воздуха 70%, при температуре 20 ℃ влажность составляет 30%, во сколько раз давление насыщенного пара при высокой температуре больше, чем при низкой?
Решение:
- Необходимо перевести градусы Цельсия в кельвины. 10+273 = 283 К, 20+273=293 К.
- Так как объем помещения постоянный, а воздух в нем ненасыщенный, то можно применить уравнение Шарля: Р1/Р2 = Т1/Т2
- Из уравнения влажности следует: Р = φ* Рн/100.
Подставляя значение Р в формулу уравнения Шарля: φ1* Рн1/ φ2* Рн2 = Т1/Т2.
Рн2/ Рн1 = Т2* φ1/Т1* φ2 = 293*70/283*30=2,4.
Использование под избыточным давлением
Если за точку отсчета взять атмосферное давление, то все, что свыше его называют избыточным. Оно создается искусственно в замкнутых объемах (трубах, сосудах, паровых котлах), измеряют манометром, потому встречается еще одно название – монометрическое.
Р абсолютное = Р атмосферное + Р избыточное. Дело в том, что при Р избыточном вода начинает кипеть не при 100 градусах, а выше. Температура достигает значений 110-160 градусов. Создаются прекрасные условия для дезинфекции и разогрева веществ.
Насыщенный пар применяют:
Чтобы убивать микробы, грибок, вирусы.
- Им стерилизуют хирургический инструмент, лабораторные приборы, оборудование, одежду. Метод применим к материалам, неподвергающимся коррозии.
- В парогенераторах для быстрого размораживания льда, пластов наледи, предотвращения смерзания песка и гравия.
- Для подогревания различных смесей в строительной, пищевой, химической промышленности.
- В пароочистителях. Им удаляют загрязнения и проводят дезинфекцию поверхностей.
Прибор для стилизации насыщенным паром называется паровым автоклавом.
Применение в жизни
Знания о насыщенном паре применяют при приготовлении пищи. Есть прибор, называемый скороваркой. Это плотно закрытая кастрюля, в которой собирается пар под высоким давлением. Благодаря этому температура кипения в скороварке повышается. И можно быстрее готовить пищу.
В горах, наоборот, сварить овощи становится проблематично, так как из-за низкого значения Р Т кипения понижается. Вода выкипает, не успев достаточно разогреть продукты.
В жизни также приходится сталкиваться с понятием «точка росы». Это Т, при которой водяной пар становится насыщенным при постоянном Р. В таких условиях в воздухе начинается образовываться конденсат.
Если в помещении точка росы выше 20 ℃, это указывает на высокую влажность, люди чувствуют духоту, дискомфорт, им тяжело двигаться, работать. Точку росы учитывают строители, применяя тепло и влагоизоляционные материалы.
Заключение
Один из важных параметров насыщенного пара – давление. Оно не зависит от объема, а при нагревании вещества повышается, причем быстрее, чем у обычного газа. При фиксированной температуре насыщенный пар принимает максимальную плотность.
Пар под избыточным давлением имеет широкое применение в быту, промышленности и медицине, так как он закипает при температуре более 100 ℃.
А какова Ваша оценка данной статье?
Насыщенный пар
-
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
-
Испарение и конденсация
-
Динамическое равновесие
-
Свойства насыщенного пара
-
Влажность воздуха
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
Если открытый стакан с водой оставить на долгое время, то в конце концов вода полностью улетучится. Точнее — испарится. Что такое испарение и почему оно происходит?
Испарение и конденсация
При данной температуре молекулы жидкости обладают разными скоростями. Скорости большинства молекул находятся вблизи некоторого среднего значения (характерного для этой температуры). Но попадаются молекулы, скорости которых значительно отличаются от средней как в меньшую, так и большую сторону.
На рис. 1 изображён примерный график распределения молекул жидкости по скоростям. Голубым фоном показано то самое большинство молекул, скорости которых группируются около среднего значения. Красный «хвост» графика — это небольшое число «быстрых» молекул, скорости которых существенно превышают среднюю скорость основной массы молекул жидкости.
Рис. 1. Распределение молекул по скоростям
Когда такая весьма быстрая молекула окажется на свободной поверхности жидкости (т.е. на границе раздела жидкости и воздуха), кинетической энергии этой молекулы может хватить на то, чтобы преодолеть силы притяжения остальных молекул и вылететь из жидкости. Данный процесс и есть испарение, а молекулы, покинувшие жидкость, образуют пар.
Итак, испарение — это процесс превращения жидкости в пар, происходящий на свободной поверхности жидкости (при особых условиях превращение жидкости в пар может происходить по всему объёму жидкости. Данный процесс вам хорошо известен — это кипение).
Может случиться, что через некоторое время молекула пара вернётся обратно в жидкость.
Процесс перехода молекул пара в жидкость называется конденсацией. Конденсация пара — процесс, обратный испарению жидкости.
к оглавлению ▴
Динамическое равновесие
А что будет, если сосуд с жидкостью герметично закрыть? Плотность пара над поверхностью жидкости начнёт увеличиваться; частицы пара будут всё сильнее мешать другим молекулам жидкости вылетать наружу, и скорость испарения станет уменьшаться. Одновременно начнёт увеличиваться скорость конденсации, так как с возрастанием концентрации пара число молекул, возвращающихся в жидкость, будет становиться всё больше.
Наконец, в какой-то момент скорость конденсации окажется равна скорости испарения. Наступит динамическое равновесие между жидкостью и паром: за единицу времени из жидкости будет вылетать столько же молекул, сколько возвращается в неё из пара. Начиная с этого момента количество жидкости перестанет убывать, а количество пара — увеличиваться; пар достигнет «насыщения».
Насыщенный пар — это пар, который находится в состоянии динамического равновесия со своей жидкостью. Пар, не достигший состояния динамического равновесия с жидкостью, называется ненасыщенным.
Давление и плотность насыщенного пара обозначаются и
. Очевидно,
и
— это максимальные давление и плотность, которые может иметь пар при данной температуре. Иными словами, давление и плотность насыщенного пара всегда превышают давление и плотность ненасыщенного пара.
к оглавлению ▴
Свойства насыщенного пара
Оказывается, что состояние насыщенного пара (а ненасыщенного — тем более) можно приближённо описывать уравнением состояния идеального газа (уравнением Менделеева — Клапейрона). В частности, имеем приближённое соотношение между давлением насыщенного пара и его плотностью:
(1)
Это весьма удивительный факт, подтверждаемый экспериментом. Ведь по своим свойствам насыщенный пар существенно отличается от идеального газа. Перечислим важнейшие из этих отличий.
1. При неизменной температуре плотность насыщенного пара не зависит от его объёма.
Если, например, насыщенный пар изотермически сжимать, то его плотность в первый момент возрастёт, скорость конденсации превысит скорость испарения, и часть пара конденсируется в жидкость — до тех пор, пока вновь не наступит динамическое равновесие, в котором плотность пара вернётся к своему прежнему значению.
Аналогично, при изотермическом расширении насыщенного пара его плотность в первый момент уменьшится (пар станет ненасыщенным), скорость испарения превысит скорость конденсации, и жидкость будет дополнительно испаряться до тех пор, пока опять не установится динамическое равновесие — т.е. пока пар снова не станет насыщенным с прежним значением плотности.
2. Давление насыщенного пара не зависит от его объёма.
Это следует из того, что плотность насыщенного пара не зависит от объёма, а давление однозначно связано с плотностью уравнением (1).
Как видим, закон Бойля — Мариотта, справедливый для идеальных газов, для насыщенного пара не выполняется. Это и не удивительно — ведь он получен из уравнения Менделеева — Клапейрона в предположении, что масса газа остаётся постоянной.
3. При неизменном объёме плотность насыщенного пара растёт с повышением температуры и уменьшается с понижением температуры.
Действительно, при увеличении температуры возрастает скорость испарения жидкости.
Динамическое равновесие в первый момент нарушается, и происходит дополнительное испарение некоторой части жидкости. Пара будет прибавляться до тех пор, пока динамическое равновесие вновь не восстановится.
Точно так же при понижении температуры скорость испарения жидкости становится меньше, и часть пара конденсируется до тех пор, пока не восстановится динамическое равновесие — но уже с меньшим количеством пара.
Таким образом, при изохорном нагревании или охлаждении насыщенного пара его масса меняется, поэтому закон Шарля в данном случае не работает. Зависимость давления насыщенного пара от температуры уже не будет линейной функцией.
4. Давление насыщенного пара растёт с температурой быстрее, чем по линейному закону.
В самом деле, с увеличением температуры возрастает плотность насыщенного пара, а согласно уравнению (1) давление пропорционально произведению плотности на температуру.
Зависимость давления насыщенного пара от температуры является экспоненциальной (рис. 2). Она представлена участком 1–2 графика. Эту зависимость нельзя вывести из законов идеального газа.
Рис. 2. Зависимость давления пара от температуры
В точке 2 вся жидкость испаряется; при дальнейшем повышении температуры пар становится ненасыщенным, и его давление растёт линейно по закону Шарля (участок 2–3).
Вспомним, что линейный рост давления идеального газа вызван увеличением интенсивности ударов молекул о стенки сосуда. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще — ведь пара становится больше. Одновременным действием этих двух факторов и вызван экспоненциальный рост давления насыщенного пара.
к оглавлению ▴
Влажность воздуха
Воздух, содержащий водяной пар, называется влажным.Чем больше пара находится в воздухе, тем выше влажность воздуха.
Абсолютная влажность — это парциальное давление водяного пара, находящегося в воздухе (т. е. давление, которое водяной пар оказывал бы сам по себе, в отсутствие других газов). Иногда абсолютной влажностью называют также плотность водяного пара в воздухе.
Относительная влажность воздуха — это отношение парциального давления водяного пара в нём к давлению насыщенного водяного пара при той же температуре. Как правило, это отношение выражают в процентах:
Из уравнения Менделеева-Клапейрона (1) следует, что отношение давлений пара равно отношению плотностей. Так как само уравнение (1), напомним, описывает насыщенный пар лишь приближённо, мы имеем приближённое соотношение:
Одним из приборов, измеряющих влажность воздуха, является психрометр. Он включает в себя два термометра, резервуар одного из которых завёрнут в мокрую ткань. Чем ниже влажность, тем интенсивнее идёт испарение воды из ткани, тем сильнее охлаждается резервуар «мокрого» термометра, и тем больше разность его показаний и показаний сухого термометра. По этой разности с помощью специальной психрометрической таблицы определяют влажность воздуха.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Насыщенный пар» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
07.02.2023
От чего зависит давление насыщенного пара
Давление насыщенного пара является одной их характеристик различных жидкостей и приводится в качестве справочного материала в специальной литературе. Знание этой величины позволяет путём изменения внешнего давления побудить жидкость закипеть или, наоборот, образовать конденсат из газообразного продукта.
Поскольку насыщенный пар представляет собой один из компонентов термодинамически равновесной системы гомогенного по составу, но различного по фазовым фракциям вещества, то понимание влияния отдельных физических факторов на величину создаваемого им давления позволяют использовать эти знания в практической деятельности, например, при определении скорости выгорания тех или иных жидкостей в случае возгорания и пр.
Давление насыщенного пара становится тем больше, чем больше увеличивается температура. При этом изменение величин не является прямо пропорциональным, а происходит значительно быстрее. Это связано с тем, что с увеличением температуры ускоряется движение молекул относительно друг друга и им легче преодолеть силы взаимного притяжения и перейти в иную фазу, т.е. количество молекул в жидком состоянии уменьшается, а в газообразном возрастает до тех пор, пока вся жидкость не превратится в пар. Это увеличивающееся давление и обусловливает поднимание крышки в кастрюле или чайнике, когда начинает закипать вода.
На величину давления насыщенного пара оказывает влияние и количество перешедших в газообразное состояние молекул, так как их число определяет массу образующегося пара в закрытом сосуде. Эта величина не является постоянной, так как при разности температур дна сосуда и закрывающей его крышки постоянно происходят два взаимно противоположных процесса – парообразование и конденсация.
Поскольку для каждого вещества при определённой температуре существуют известные показатели перехода определённого количества молекул из одной фазы состояния вещества в другую, то изменить величину давления насыщенного пара можно путём изменения объёма сосуда. Так, один и тот же объём воды, например 0,5 л, создаст разное по величине давление в пятилитровой канистре и литровом чайнике.
Определяющим фактором для определения справочной величины давления насыщенного пара при неизменном объёме и постепенном повышении температуры является молекулярная структура самой жидкости, подвергаемой нагреванию. Так, показатели для ацетона, спирта и обычной воды будут существенно отличаться друг от друга.
Чтобы увидеть процесс кипения жидкости необходимо не только довести давление насыщенного пара до определённых пределов, но и соотнести эту величину с внешним атмосферным давлением, так как процесс кипения возможен только в том случае, когда давление снаружи выше давления внутри сосуда.
Источники:
- Бинарные жидкие системы
Из повседневного опыта мы знаем, что жидкости, например вода,
находясь в открытых сосудах, с течением времени переходят в газообразное
состояние. Такой процесс в физике называется парообразованием.
Переход вещества из жидкого состояния в газообразное возможен
двумя различными процессами: испарением и кипением.
Под испарением мы с вами будем понимать процесс
парообразования, происходящий со свободной поверхности жидкости, граничащей с
газообразной средой или вакуумом.
Рассмотрим процесс испарения с точки зрения
молекулярно-кинетической теории вещества. Но для начала давайте вспомним, что
молекулы вещества в любом его агрегатном состоянии находятся в непрерывном
движении. Их скорости меняются самым случайным образом. И несмотря на то, что
среднее значение кинетической энергии молекул при заданной температуре имеет
определённое значение, кинетическая энергия отдельной молекулы может быть как
больше, так и меньше средней:
Наиболее быстрые молекулы, находящиеся в верхних слоях
жидкости, могут преодолеть силы притяжения к другим молекулам и покинуть
жидкость. А так как молекулы с большой энергией есть всегда, то со временем
количество жидкости будет уменьшаться, а над жидкостью будет образовываться
пар.
Поскольку при испарении поверхность жидкости покидают самые
быстрые молекулы, то средняя кинетическая энергия оставшихся молекул
уменьшается, и в результате температура жидкости понижается.
Скорость испарения жидкости зависит от многих факторов: от её
рода, температуры, площади свободной поверхности и от притока воздуха.
Вылетевшая из жидкости молекула принимает участие в
беспорядочном тепловом движении газа. Хаотично двигаясь, она может навсегда
удалиться от поверхности жидкости, находящейся в открытом сосуде, а может и
вернуться снова в жидкость.
Процесс превращения пара в жидкость называется
конденсацией. При этом процессе число молекул, возвращающихся в жидкость за
определённый промежуток времени, всегда больше числа молекул, покидающих её.
Процессы испарения и конденсации широко распространены в
природе и технике. Так, например, вследствие испарения воды с поверхности
водной оболочки Земли — гидросферы, с поверхности почвы и растительного покрова
в воздухе всегда находятся водяные пары, которые могут конденсироваться,
образовывать облака и выпадать в виде осадков.
Над свободной поверхностью жидкости всегда имеются пары этой
жидкости. И если сосуд с жидкостью не закрыт, то концентрация частиц пара при
постоянной температуре может изменяться достаточно в широких пределах как в
сторону уменьшения, так и в сторону увеличения.
Однако процесс испарения в замкнутое пространство при данной
температуре может происходить только до определённого предела. Объясняется это
достаточно просто. Вот есть сосуд, который частично заполнили водой и плотно
закрыли. В сосуде одновременно протекают два противоположно направленных
процесса — это испарение и переход водяного пара в жидкость, то есть
конденсация.
В течение некоторого промежутка времени после герметизации
сосуда испарение жидкости преобладает над конденсацией её пара. Количество
жидкости в сосуде будет уменьшаться, а плотность пара над ней — увеличиваться.
Но концентрация пара в закрытом сосуде не может расти вечно. Со временем число
молекул, покидающих жидкость, станет равным числу молекул, возвращающихся в
неё, за тот же промежуток времени. В этом случае говорят, что между жидкостью и
паром устанавливается состояние динамического равновесия.
Пар, находящийся в состоянии динамического равновесия со
своей жидкостью, называют насыщенным.
А теперь давайте нагреем наш сосуд, в котором жидкость и пар
находятся в состоянии динамического равновесия. Нетрудно заметить, что при
увеличении температуры, количество молекул, которые покидают поверхность
жидкости, возрастает. При этом в начале количество молекул, покидающих
жидкость, больше, чем тех, которые возвращаются обратно, то есть нарушается
динамическое равновесие. Однако через какое-то время равновесие вновь восстанавливается.
Но так как число молекул в единице объёма пара увеличилось по сравнению с
первоначальным, то увеличилась и плотность насыщенного пара. А мы уже знаем,
что при увеличении плотности газа возрастает и его давление.
Значит, с увеличением температуры, плотность и давление
насыщенного пара увеличиваются. Приближённо зависимость давления
насыщенного пара от температуры можно описать уравнением состояния идеального
газа:
p
= nkT.
Почему приближённо? Дело в том, что давление насыщенного
пара при постоянном объёме растёт не только вследствие повышения температуры
жидкости, но и вследствие увеличения концентрации молекул пара и, как следствие,
его плотности и массы.
Поэтому вначале давление насыщенного пара растёт быстрее, чем
давление идеального газа. И лишь когда вся жидкость испарится, пар перестанет
быть насыщенным и его давление при постоянном объёме будет расти прямо пропорционально
температуре.
Вернём нашу систему в исходное состояние и посмотрим, как
поведёт себя насыщенный пар, если уменьшить занимаемый им объём. Сразу при
уменьшении объёма пара его давление увеличивается, что тут же приводит к
возрастанию количества молекул, переходящих в жидкость, и динамическое
равновесие нарушается. Но вот число молекул, которые покидают поверхность
жидкости, не меняется, так как оно зависит только от температуры, которая у нас
остаётся неизменной. В результате количество молекул пара уменьшается. Этот
процесс продолжается до тех пор, пока вновь не установится динамическое
равновесие и плотность пара, а, следовательно, его давление и концентрация
молекул не примут своих прежних значений.
Таким образом, при постоянной температуре давление и
плотность насыщенного пара не зависят от занимаемого им объёма.
Давление и плотность насыщенного пара при данной
температуре — это максимальные давление и плотность, которое может иметь пар,
находящийся в состоянии динамического равновесия со своей жидкостью при этой
температуре.
Пар, давление (или плотность) которого меньше давления (или
плотности) насыщенного пара при той же температуре, называют ненасыщенным
паром.
При уменьшении объёма давление ненасыщенного пара
увеличивается подобно тому, как изменяется давление при уменьшении объёма
идеального газа. Достигнув определённого объёма, пар становится насыщенным, и
при дальнейшем сжатии будет происходить превращение пара в жидкость. А как
только весь пар превратится в жидкость, дальнейшее уменьшение объёма вызовет
резкое увеличение давления, так как жидкости малосжимаемы.
Но самое интересное в этом то, что если температура пара выше
некоторого значения, то, как бы мы ни сжимали его, он никогда не превратится в
жидкость. То есть превращение пара в жидкость происходит не при любой
температуре. Максимальная температура, при которой пар ещё может
превратиться в жидкость, называется критической температурой.
У каждого вещества своя критическая температура.
Запомните, что состояние вещества при температуре выше
критической называется газом; при температуре ниже критической, когда у пара
есть возможность превратиться в жидкость, — паром.
Обобщив всё вышесказанное, можно утверждать, что газовые
законы для насыщенного пара не применимы, так как при любом объёме при
постоянной температуре давление насыщенного пара одинаково. Однако состояние
насыщенного пара достаточно точно описывается уравнением Клайперона —
Менделеева.
А теперь давайте посмотрим, как будет происходить испарение
жидкости, если к ней постоянно подводить теплоту. Возьмём сосуд с водой и
установим под него какой-нибудь нагреватель (например, спиртовку или
электроплитку). С помощью термометра будем следить за показаниями температуры в
сосуде. Понаблюдаем за жидкостью. Как видим, по мере роста температуры на дне
сосуда появляется множество пузырьков. Это растворённый в жидкости газ, который
всегда присутствует в жидкости, и степень растворения которого понижается с
ростом температуры. При нагревании жидкости снизу газ начинает выделяться в
виде пузырьков у дна и стенок сосуда.
В эти пузырьки происходит испарение жидкости. Поэтому в них,
кроме воздуха, находится насыщенный пар, давление которого с ростом температуры
быстро увеличивается, и пузырьки растут в объёме, а следовательно,
увеличиваются действующие на них силы Архимеда. Когда выталкивающая сила станет
больше силы тяжести пузырька, он начинает всплывать. Но пока жидкость не будет
равномерно прогрета, по мере всплытия объём пузырька уменьшается. Давление
стремительно падает, и, не достигнув свободной поверхности, пузырьки исчезают
(захлопываются). Этот процесс происходит настолько быстро, что стенки пузырька,
сталкиваясь, производят нечто вроде взрыва. Вот почему мы слышим характерный
шум перед закипанием воды.
Когда температура жидкости выровняется, объём пузырька при
подъёме будет возрастать, так как давление насыщенного пара не изменяется, а
внешнее давление на пузырёк, представляющее собой сумму гидростатического
давления жидкости, находящейся над пузырьком, и атмосферного давления,
уменьшается. Пузырёк достигает свободной поверхности жидкости, лопается, и
насыщенный пар выходит наружу — жидкость закипает.
Кипение — это процесс парообразования, происходящий по
всему объёму жидкости.
Температура, при которой происходит кипение жидкости,
называется температурой кипения.
Конечно же, температура кипения у разных жидкостей различна.
Это и понятно, ведь различна энергия взаимодействия их молекул. В таблице,
которую вы сейчас видите на экране, приведены температуры кипения жидкостей при
нормальном атмосферном давлении. А как выдумаете, случайно ли мы, говоря о
температуре кипения жидкости, указываем давление?
Конечно же, неслучайно. Пузырьки кипящей жидкости лопаются
при условии, что давление пара в них не меньше, чем давление снаружи. Значит,
чем меньше внешнее давление, тем при более низкой температуре закипит жидкость.
И наоборот.
Для подтверждения наших слов, проведём такой опыт. Возьмём
три сосуда с водой, находящихся в герметичных камерах. Тепло к сосудам будем
подводить при помощи электрических нагревателей, а температуру измерять
термометрами. Пусть во второй камере давление воздуха составляет одну
атмосферу, в первой камере мы снизим давление в два раза, откачав воздух. А в
третьей камере мы давление воздуха увеличим до пяти атмосфер.
Включи́м плитки и пронаблюдаем за жидкостями. Первой у
нас закипает вода в первой камере. При этом обратите внимание: кипит она при
температуре всего 81 оС. Вода в камере с нормальным давлением, как и
ожидалось, закипела при 100 оС.
А что же в камере номер три? Вода кипит в ней при температуре
более 151 оС.
Таким образом, мы показали, что действительно чем меньше
внешнее давление, тем при более низкой температуре закипит жидкость, и
наоборот.
Если же предварительно освободить жидкость от растворенного в
ней газа, то её можно перегреть, то есть нагреть выше температуры кипения. Это
неустойчивое состояние жидкости. Достаточно небольших сотрясений и жидкость
закипает, а её температура сразу понижается до температуры кипения.
Фазовые переходы: изменение агрегатных состояний вещества
Прежде чем говорить о насыщенном паре, нужно освежить знания об агрегатных состояниях и фазовых переходах между ними. Если вы забыли, какие бывают агрегатные состояния, то можете сбегать в нашу статью про них.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Вот какие бывают фазовые переходы:
-
Переход из твердого состояния в жидкое — плавление;
-
Переход из жидкого состояния в твердое — кристаллизация;
-
Переход из газообразного состояния в жидкое — конденсация;
-
Переход из жидкого состояния в газообразное — парообразование;
-
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
-
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
На схеме — названия всех фазовых переходов:
Фазовые переходы — важная штука. Все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы в металлургии и микроэлектронике.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Пятерка по физике у тебя в кармане!
Решай домашку по физике на изи. Подробные решения помогут разобраться в сложной теме и получить пятерку!
Парообразование
Итак, парообразование — это переход из жидкого состояния в газообразное.
При парообразовании всегда происходит поглощение энергии: к веществу необходимо подводить теплоту, чтобы оно испарялось. Из-за этого внутренняя энергия вещества увеличивается.
У процесса парообразования есть две разновидности: испарение и кипение.
-
Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости. Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
-
Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Например, мы заварили себе горячий чай. Над чашкой мы увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. 🤔 Это действительно так, но при этом оба процесса могут происходить параллельно.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха, и из-за разницы температур происходит испарение.
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
-
из глубины жидкости к поверхности, а затем в воздух;
-
только из жидкости к поверхности;
-
к поверхности из воды и газовой среды одновременно;
-
к площади поверхности только от воздуха.
Подытожим, чтобы не запутаться, в чем главная разница между испарением и кипением:
|
Испарение |
Кипение |
|---|---|
|
|
Температура кипения
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость — чаще всего это атмосферное давление. Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
При нормальном атмосферном давлении, которое приблизительно равно 100 кПа, температура кипения воды равна 100°C. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре 100 градусов по Цельсию равно 100 кПа. Это значение пригодится при решении задач.
Чем выше мы поднимаемся, тем меньше становится атмосферное давление, потому что масса атмосферы над нами уменьшается. Так, например, на вершине Эльбруса атмосферное давление составляет 5 × 104 Па — в два раза меньше, чем нормальное атмосферное давление. Поэтому и температура кипения на вершине Эльбруса будет ниже, чем на уровне моря. Вода там закипит при температуре 82°C.
Температура кипения при нормальном атмосферном давлении — это строго определенная величина для каждой жидкости.
|
t, °C |
Вещество |
|---|---|
|
-253 -183 35 78 100 357 3050 4200 5657 |
водород кислород эфир спирт вода ртуть железо графит вольфрам |
Испарение и конденсация
Молекулы в жидкости непрерывно и хаотично движутся. Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Значения скоростей молекул случайны. Из-за этого среди всех молекул обязательно есть те, что движутся очень быстро. Если такая молекула окажется вблизи поверхности раздела жидкости и окружающей среды, то ее кинетическая энергия может достигнуть большого значения, и молекула покинет жидкость.
Собственно, именно так происходит процесс испарения (мы говорили о нем выше, когда речь шла о фазовых переходах). Когда испарившихся молекул становится много, образуется пар.
Обратный процесс тоже возможен: вырвавшиеся за пределы жидкости молекулы вернутся в жидкость. Это конденсация, о ней мы тоже говорили.
Если открыть сосуд с жидкостью, то испарившиеся молекулы будут покидать пространство над жидкостью и не возвращаться обратно. Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Испарение может происходить с разной скоростью. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии преодолеть эти силы притяжения и вылететь наружу, и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее — вода. Намного медленнее воды испаряются масло и ртуть.
Курсы подготовки к ОГЭ по физике помогут снять стресс перед экзаменом и получить высокий балл.
Определение насыщенного пара
Оставим стакан воды на столе и будем замерять уровень воды в нем каждый день. Если записать эти измерения и сравнить их, станет очевидно: уровень воды стал меньше, то есть вода испарилась.
Теперь давайте накроем стакан сверху. Молекулы пара уже не смогут покидать пространство над жидкостью, по мере испарения их количество начнет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Сначала количество конденсирующихся молекул за единицу времени будет меньше количества испаряющихся молекул. Но по мере роста концентрации пара (то есть увеличении количества молекул в единице объема пара) поток конденсирующихся молекул вырастет. Это приведет к состоянию, которое называется динамическим равновесием.
Пар, находящейся в динамическом равновесии, называют насыщенным.
Представьте себе огромный бизнес-центр с не менее огромными дверями. У сотрудников бизнес-центра разный график работы, поэтому люди одновременно заходят в здание и выходят из него в произвольном количестве. Допустим, в 6 часов вечера 100 человек заходят в здание, чтобы попасть на деловую встречу, а другие 100 человек уже закончили работать и идут домой. Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный.
Свойства насыщенного пара
-
При постоянной температуре плотность насыщенного пара не зависит от его объема.
Представьте, что объем сосуда с насыщенным паром уменьшили, не изменив температуры.
Количество молекул, переходящих от пара к жидкости, превысит количество испаряющихся молекул, но при этом часть пара сконденсируется, а оставшийся пар снова придет в динамическое равновесие. В итоге плотность этого пара будет равна начальной плотности.
-
Давление насыщенного пара не зависит от его объема.
Это связано с тем, что давление и плотность связаны через уравнение Менделеева-Клапейрона, и следует из первого свойства насыщенного пара.
Кстати, уравнение Менделеева-Клапейрона справедливо для насыщенного пара. При этом нужно быть внимательным с частными случаями. Так, например, закон Бойля-Мариотта для насыщенного пара не выполняется.
Уравнение Менделеева-Клапейрона
pV = νRT
p — давление газа [Па]
V — объем [м3]
ν — количество вещества [моль]
T — температура [К]
R — универсальная газовая постоянная
R = 8,31 м2 × кг × с-2 × К-1 × моль-1
-
При неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры.
В начальный момент испарения динамическое равновесие будет нарушено (некоторая часть жидкости испарится дополнительно). Плотность пара будет расти, пока динамическое равновесие не восстановится.
-
Давление и температура насыщенного пара растут быстрее, чем по линейному закону, который справедлив для идеального газа.
В случае идеального газа рост давления обусловлен только ростом температуры, а в случае с насыщенном паром имеют значение два фактора: температура и масса пара.
В случае нагревания насыщенного пара молекулы начинают ударяться чаще, так как их в целом стало больше, потому что пара стало больше.
Главное отличие насыщенного пара от идеального газа: пар сам по себе не является замкнутой системой, а находится в постоянном контакте с жидкостью.
Решение задач по теме «Насыщенный пар»
Применим свойства насыщенного пара при решении задач.
-
Задачка раз
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните.
Решение
Так как пар и вода находятся в контакте длительное время, пар является насыщенным. При уменьшении объема сосуда давление насыщенного пара не меняется. Из уравнения Менделеева-Клапейрона следует, что для того, чтобы давление пара не менялось, его количество вещества (а значит и масса) должно уменьшаться.
pV = νRT
В этом процессе происходит конденсация, часть молекул пара переходят в жидкость, поэтому масса жидкости увеличивается.
Ответ
Масса жидкости увеличивается.
-
Задачка два
Какова плотность насыщенного пара при температуре 100°С?
Решение
При нормальном давлении (p = 105 Па) 100°С — это температура кипения воды. Значит, давление насыщенного пара при этой температуре равно атмосферному давлению.
Найдем связь между давлением и плотностью через уравнение Менделеева-Клапейрона.
Подставим значение давления в уравнение состояния идеального газа, предварительно переведя температуру в Кельвины:
T = 100 + 273 = 373 K
-
Давление насыщенного пара.
И что будет происходить с насыщенным
паром, если уменьшить занимаемый им
объем? Например, если сжимать пар,
находящийся в равновесии с жидкостью
в цилиндре под поршнем, поддерживая
температуру содержимого цилиндра
постоянной.
При сжатии пара равновесие
начнет нарушаться. Плотность пара в
первый момент немного увеличится, и из
газа в жидкость начнет переходить
большее число молекул, чем из жидкости
в газ. Ведь число молекул, покидающих
жидкость в единицу времени, зависит
только от температуры, и сжатие пара
это число не меняет. Процесс продолжается
до тех пор, пока вновь не установится
динамическое равновесие и плотность
пара, а значит, и концентрация его молекул
не примут прежнее значение. Следовательно,
концентрация молекул
насыщенного пара при постоянной
температуре не зависит от его объема.
Так как давление пропорционально
концентрации молекул (p
= nkT),
то из этого определения
следует, что давление
насыщенного пара не зависит oт
занимаемого им объема.
Давление пара
,
при котором жидкость
находится в равновесии со своим паром,
называют давлением насыщенного пара.
-
Ненасыщенный пар.
Мы много раз употребляли
слова газ и
пар. Никакой
принципиальной разницы между газом и
паром нет. Но если при
неизменной температуре газ простым
сжатием можно превратить в жидкость,
то мы называем его паром, точнее,
ненасыщенным паром.
-
Зависимость давления насыщенного пара от температуры.
Состояние
насыщенного
пара, как говорит опыт, приближенно
описывается уравнением
состояния идеального газа,
а его давление определяется формулой
С ростом температуры давление
растет.
Так как д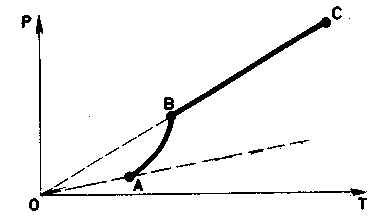
насыщенного
пара не зависит от объема, оно
зависит только от
температуры.
Однако
эта зависимость ро(Т),
найденная
экспериментально, не является
прямо пропорциональной, как
у идеального газа при постоянном
объеме. С увеличением температуры
давление насыщенного пара растет
быстрее, чем давление идеального
газа (рис. 30, участок кривой АВ).
Это становится
особенно очевидным,
если провести изохору через точку
А
(пунктирная
прямая) Почему
это происходит?
Однако эта зависимость
р(Т), найденная
экспериментально, не является
прямо пропорциональной, как
у идеального газа при постоянном
объеме. С увеличением температуры
давление насыщенного парабыстрее,
чем давление идеального
газа (рис. 30).Почему это
происходит?
При
нагревании жидкости в закрытом
сосуде часть жидкости превращается
в пар. В результате согласно
формуле
давление
насыщенного
пара растет не только вследствие
повышения температуры жидкости,
но и вследствие увеличения
концентрации молекул (плотности)
пара.
В основном
увеличение давления при повышении
температуры определяется именно
увеличением концентрации. Главное
различие в поведении идеального газа
и насыщенного пара состоит в том, что
при изменении температуры пара в закрытом
сосуде (или при изменении объема при
постоянной температуре) меняется масса
пара. Жидкость частично превращается
в пар или, напротив, пар частично
конденсируется. Когда вся жидкость
испарится, пар при дальнейшем нагревании
перестанет быть насыщенным и его давление
при постоянном объеме будет возрастать
прямо пропорционально абсолютной
температуре (см. рис. 30, участок ВС).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Насыщенный пар.

Если сосуд с жидкостью плотно закрыть, то сначала количество жидкости уменьшится, а затем
будет оставаться постоянным. При неизменной температуре система жидкость — пар
придет в состояние теплового равновесия и будет находиться в нем сколь угодно
долго. Одновременно с процессом испарения происходит и конденсация, оба
процесса в среднем компенсируют друг друга. В первый момент, после того как
жидкость нальют в сосуд и закроют его, жидкость будет испаряться и плотность
пара над ней будет увеличиваться. Однако одновременно с этим будет расти и
число молекул, возвращающихся в жидкость. Чем больше плотность пара, тем
большее число его молекул возвращается в жидкость. В результате в закрытом
сосуде при постоянной температуре установится динамическое (подвижное)
равновесие между жидкостью и паром, т. е. число молекул, покидающих поверхность
жидкости за некоторый промежуток времени, будет равно в среднем числу молекул
пара, возвратившихся за то же время в жидкость. Пар, находящийся в динамическом
равновесии со своей жидкостью, называют насыщенным паром. Это определение
подчеркивает, что в данном объеме при данной температуре не может находиться
большее количество пара.
Более подробно здесь
Давление насыщенного пара.
Что будет
происходить с насыщенным паром, если уменьшить занимаемый им объем? Например,
если сжимать пар, находящийся в равновесии с жидкостью в цилиндре под поршнем,
поддерживая температуру содержимого цилиндра постоянной. При сжатии пара
равновесие начнет нарушаться. Плотность пара в первый момент немного увеличится,
и из газа в жидкость начнет переходить большее число молекул, чем из жидкости в
газ. Ведь число молекул, покидающих жидкость в единицу времени, зависит только
от температуры, и сжатие пара это число не меняет. Процесс продолжается до тех
пор, пока вновь не установится динамическое равновесие и плотность пара, а
значит, и концентрация его молекул не примут прежних своих значений.
Следовательно, концентрация молекул насыщенного пара при постоянной температуре
не зависит от его объема. Так как давление пропорционально концентрации молекул
(p=nkT), то из этого определения следует, что давление насыщенного пара не
зависит от занимаемого им объема. Давление pн.п. пара, при котором
жидкость находится в равновесии со своим паром, называют давлением насыщенного
пара.
Зависимость давления насыщенного
пара от температуры.
Состояние
насыщенного пара, как показывает опыт, приближенно описывается уравнением
состояния идеального газа, а его давление определяется формулой Р = nкТ С
ростом температуры давление растет. Так как давление насыщенного пара не
зависит от объема, то, следовательно, оно зависит только от температуры. Однако
зависимость рн.п. от Т, найденная экспериментально, не является
прямо пропорциональной, как у идеального газа при постоянном объеме. С увеличением
температуры давление реального насыщенного пара растет быстрее, чем давление
идеального газа (рис. участок кривой 12). Почему это происходит? При нагревании
жидкости в закрытом сосуде часть жидкости превращается в пар. В результате
согласно формуле Р = nкТ давление насыщенного пара растет не только вследствие
повышения температуры жидкости, но и вследствие увеличения концентрации молекул
(плотности) пара. В основном увеличение давления при повышении температуры
определяется именно увеличением концентрации. (Главное различие в поведении
идеального газа и насыщенного пара состоит в том, что при изменении температуры
пара в закрытом сосуде (или при изменении объема при постоянной температуре)
меняется масса пара. Жидкость частично превращается в пар, или, напротив, пар
частично конденсируется. С идеальным газом ничего подобного не происходит.). Когда вся жидкость испарится, пар при дальнейшем нагревании перестанет быть
насыщенным и его давление при постоянном объеме будет возрастать прямо
пропорционально абсолютной температуре (см. рис., участок кривой 23).
Кипение.
Кипение –
это интенсивный переход вещества из жидкого состояния в газообразное,
происходящее по всему объему жидкости (а не только с ее поверхности).
(Конденсация – обратный процесс.) По мере увеличения температуры жидкости
интенсивность испарения увеличивается. Наконец, жидкость начинает кипеть. При
кипении по всему объему жидкости образуются быстро растущие пузырьки пара,
которые всплывают на поверхность. Температура кипения жидкости остается
постоянной. Это происходит потому, что вся подводимая к жидкости энергия
расходуется на превращение ее в пар. При каких условиях начинается кипение?
В
жидкости всегда присутствуют растворенные газы, выделяющиеся на дне и стенках
сосуда, а также на взвешенных в жидкости пылинках, которые являются центрами
парообразования. Пары жидкости, находящиеся внутри пузырьков, являются
насыщенными. С увеличением температуры давление насыщенных паров возрастает и
пузырьки увеличиваются в размерах. Под действием выталкивающей силы они
всплывают вверх. Если верхние слои жидкости имеют более низкую температуру, то
в этих слоях происходит конденсация пара в пузырьках. Давление стремительно
падает, и пузырьки захлопываются. Захлопывание происходит настолько быстро, что
стенки пузырька, сталкиваясь, производят нечто вроде взрыва. Множество таких
микровзрывов создает характерный шум. Когда жидкость достаточно прогреется,
пузырьки перестанут захлопываться и всплывут на поверхность. Жидкость закипит.
Понаблюдайте внимательно за чайником на плите. Вы обнаружите, что перед
закипанием он почти перестает шуметь. Зависимость давления насыщенного пара от
температуры объясняет, почему температура кипения жидкости зависит от давления
на ее поверхность. Пузырек пара может расти, когда давление насыщенного пара
внутри него немного превосходит давление в жидкости, которое складывается из
давления воздуха на поверхность жидкости (внешнее давление) и гидростатического
давления столба жидкости . Кипение начинается при температуре, при которой давление
насыщенного пара в пузырьках сравнивается с давлением в жидкости. Чем больше
внешнее давление, тем выше температура кипения. И наоборот, уменьшая внешнее
давление, мы тем самым понижаем температуру кипения. Откачивая насосом воздух и
пары воды из колбы, можно заставить воду кипеть при комнатной температуре. У
каждой жидкости своя температура кипения (которая остается постоянной, пока вся
жидкость не выкипит), которая зависит от давления ее насыщенного пара. Чем выше
давление насыщенного пара, тем ниже температура кипения жидкости.
Заполни опорный конспект Контрольные вопросы
Влажность воздуха и ее измерение.
В окружающем
нас воздухе практически всегда находится некоторое количество водяных паров.
Влажность воздуха зависит от количества водяного пара, содержащегося в нем.
Сырой воздух содержит больший процент молекул воды, чем сухой. Большое значение
имеет относительная влажность воздуха, сообщения о которой каждый день звучат в
сводках метеопрогноза.
Относительная влажность — это отношение плотности
водяного пара, содержащегося в воздухе, к плотности насыщенного пара при данной
температуре, выраженное в процентах (показывает, насколько водяной пар в
воздухе близок к насыщению).
Точка росы
Сухость или
влажность воздуха зависит от того, насколько близок его водяной пар к
насыщению. Если влажный воздух охлаждать, то находящийся в нем пар можно
довести до насыщения, и далее он будет конденсироваться. Признаком того, что
пар насытился является появление первых капель сконденсировавшейся жидкости —
росы. Температура, при которой пар, находящийся в воздухе, становится
насыщенным, называется точкой росы. Точка росы также характеризует влажность
воздуха. Примеры: выпадение росы под утро, запотевание холодного стекла, если
на него подышать, образование капли воды на холодной водопроводной трубе,
сырость в подвалах домов. Для измерения влажности воздуха используют
измерительные приборы — гигрометры. Существуют несколько видов гигрометров, но
основные: волосной и психрометрический.
Так как непосредственно измерить
давление водяных паров в воздухе сложно, относительную влажность воздуха
измеряют косвенным путем. Известно, что от относительной влажности воздуха
зависит скорость испарения. Чем меньше влажность воздуха, тем легче влаге
испаряться. В психрометре есть два термометра. Один — обычный, его называют
сухим. Он измеряет температуру окружающего воздуха. Колба другого термометра
обмотана тканевым фитилем и опущена в емкость с водой. Второй термометр
показывает не температуру воздуха, а температуру влажного фитиля, отсюда и
название увлажненный термометр. Чем меньше влажность воздуха, тем интенсивнее
испаряется влага из фитиля, тем большее количество теплоты в единицу времени
отводится от увлажненного термометра, тем меньше его показания, следовательно,
тем больше разность показаний сухого и увлажненного термометров. Определив
разность показаний сухого и увлажненного термометров, по специальной таблице,
расположенной на психрометре, находят значение относительной влажности.
Источник: http://5fan.ru/wievjob.php?id=1361
Изменение — давление — насыщенный пар
Cтраница 1
Изменение давления насыщенного пара в присутствии постороннего газа происходит вследствие молекулярного взаимодействия последнего с паром и вследствие влияния общего давления на свойства конденсированной фазы.
[1]
Изменение давления насыщенного пара с температурой показано на рис. 1 ( см. стр.
[2]
Изменение давления насыщенного пара при изменении давления в жидкости носит универсальный характер и не связано исключительно с действием сил поверхностного натяжения. Вспомним, что условием фазового равновесия является равенство потенциалов Гиббса, в данном случае у жидкости и у пара. При постоянной температуре изменение потенциала Гиббса равно АФ 1 / ДР, и оно должно быть для обеих фаз одинаковым. Если, например, в сосуде, содержащем жидкость и насыщенный пар, имеется посторонний газ с парциальным давлением АР, давление пара должно измениться так, чтобы изменения потенциала АФ для пара и для жидкости были одинаковы.
[3]
Изменение давления насыщенного пара в присутствии постороннего газа происходит вследствие молекулярного взааимодействия последнего с паром и вследствие влияния общего давления на свойства конденсированной фазы.
[5]
Изменение давления насыщенного пара непропорционально изменению температуры, поэтому шкала конденсационного термометра получается неравномерной. Это — один из его недостатков.
[7]
При изменении давления насыщенного пара состав азеотроп-ного раствора в системах, обладающих минимумом на диаграмме кипения, изменяется в том же направлении, как и состав равновесного пара, а в системах, обладающих максимумом, — в противоположном направлении.
[8]
Установлены зависимости изменения давления насыщенных паров товарных нефтей применительно к процессу самотечного опорожнения трубопровода на основе проведенных экспериментальных исследований по выделению паровой фазы для нефтей среднего приобья Западной Сибири.
[9]
Ниже приводится таблица изменения давления насыщенных паров и т-ры вспышки реактивного топлива ТС-1 в зависимости от добавки бензина.
[10]
Однако в реальных системах изменение давления насыщенного пара под действием давления рВнешн не наблюдается в чистом виде, а всегда совместно с другими эффектами, так как сжимающий газ никогда не бывает совершенно инертным — он растворяется в конденсированной фазе, а молекулы конденсированной фазы растворяются в газе.
[12]
Однако в реальных системах изменение давления насыщенного пара под действием давления Рвнешн не наблюдается в чистом виде, а всегда совместно с другими эффектами, так как сжимающий газ никогда не бывает совершенно инертным — он растворяется в конденсированной фазе, а молекулы конденсированной фазы растворяются в газе.
[14]
На рис. 1 изображено изменение давления насыщенного пара растворимой и нерастворимой смесей в зависимости от состава смеси.
[15]
Страницы:
1
2
3
4



 Чтобы убивать микробы, грибок, вирусы.
Чтобы убивать микробы, грибок, вирусы.







